[化学—选修3物质结构与性质](15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| |
氟 |
氯 |
溴 |
碘 |
铍 |
| 第一电离能 (kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6(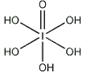 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为_____,孤电子对对数为______, I3-离子的空间构型为___________。
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。 A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)下图为碘晶体晶胞结构。有关说法中正确的是_____________。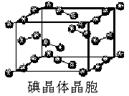
A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(8)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。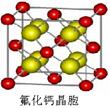
(8 分)A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):
(1)若A 是一种白色难溶于水的钙盐,由三种元素组成,C 是大气循环中的一种重要物质.则B的化学式是________,C和D反应生成A的化学方程式是_____________。
(2)若A是无色液体,D是一种黑色固体,则C的化学式是_______,由B生成D的化学方程式为____。
(3)若A是碳酸氢钠,且已知碳酸氢钠受热可分解为碳酸钠、二氧化碳和水,写出过量的气体C与D溶液反应生成A的化学方程式 。
(7 分)我国西部大部分山区的许多村庄,仍以饮用未经任何处理的地表水为主,这些地表水受到不同程度的污染,对山区群众的身体健康造成不利影响。目前国务院和各级政府投入大量资金,采取积极措施为这些 村庄建水厂、安装自来水管道,让群众喝上清洁、卫生的水。
(1)硬水可用 来区分。硬水中含有较多可溶性钙、镁化合物,硬水会给生活和生产带来许多麻烦。生活中可用_________来降低水的硬度。
(2)硬水在加热或久置时,会产生水垢[主要成分是 Mg(OH)2和 CaCO3],生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式: 、 。
(3)自来水生产过程中,可用 方法除去水中不溶性杂质,同时还必须进行消毒杀菌。ClO2是一种新型的自来水消毒剂,其中氯元素与氧元素的质量比为:_____,氯的原子结构示意图为 。
(6 分)写出用 H、C、O、Na 四种元素组成符合下列要求的物质的化学式
(1)密度最小的气体___________;
(2)天然气的主要成分_________;
(3)固体可用于冷藏食物和人工降雨的物质________;
(4)实验室用于制取氧气的物质___________;
(5)俗名为烧碱的物质___________;
(6)用于治疗胃酸过多的药物__________。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。 (1)该电池的负极材料是_________。电池工作时,电子流向____________(填“正极”或“负极”)。
(1)该电池的负极材料是_________。电池工作时,电子流向____________(填“正极”或“负极”)。 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。 a.NaOHb.Znc.Fed.NH3·H2O
a.NaOHb.Znc.Fed.NH3·H2O (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 __________。若电解电路中通过2 mol电子,MnO2的理论产量为_______g。
__________。若电解电路中通过2 mol电子,MnO2的理论产量为_______g。
(11分) 已知A、B、C、D、E、F、G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如下表所示。
| 元素 |
原子结构特征或有关物质的性质 |
| A |
原子的最外层电子数是其内层电子数的2倍 |
| B |
其单质是空气中含量最多的物质 |
| C |
原子的最外层电子数是其电子层数的4倍 |
| D |
位于第ⅡA族,其原子半径比E的大 |
| E |
是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
| F |
原子序数16,其单质在通常状况下为固体 |
| G |
原子的最外层电子数比其次外层电子数少1个 |
(1)元素F在元素周期表中的位置是_________。这七种元素中,不属于主族元素的元素的名称是 。
(2)在E、F、G三种元素中,原子半径最小的是 (填元素符号)。
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为 ,分子的空间结构为 。A与氧元素可形成化合物AO2,该化合物分子的电子式为 。
(4)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈 (填“酸”、“碱”或“中”)性,原因为________(用方程式表示)