某化学课堂围绕,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是 。
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 |
测溶液pH |
滴加Na2CO3溶液 |
滴加BaCl2溶液 |
| 实验操作 |
 |
 |
 |
| 实验现象 |
试纸变色,对比比色卡,pH<7 |
。 |
产生白色沉淀 |
| 实验结论 |
溶液中有H2SO4 |
溶液中有H2SO4 |
溶液中有H2SO4 |
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是 。
(2)实验方案中也有一个是错误的,错误的原因是 。
(10孝感8)、(5分)氢气具有还原性,能在加热条件下发生反应:H2+CuO Cu+H2O,某同学为了验证氢气还原氧化铜的产物,设计了如下由A、B、C三部分组成的实验装置。
Cu+H2O,某同学为了验证氢气还原氧化铜的产物,设计了如下由A、B、C三部分组成的实验装置。
(1)写出“a”所指仪器名称;
(2)能确认反应生成水的实验现象是;
(3)在实验室里利用A装置还可以制取那些气体?(只要求答一种)
(4)本实验缺少的仪器是;除此之外,上述实验装置还存在不足之处,为了达到实验目的,是根据现象得出的结论更严格更科学,请你提出修改意见。
(10河北35).某班同学做验证铁、铜、银的金属活动性顺序的实验,用到的药品有铁丝、铜丝、银丝、稀硫酸和硫酸铜溶液。实验结束后,化学兴趣小组的同学欲对该实验的废液进行探究,请你一起参与。
【提出问题】废液中含有什么物质?
【交流表达】
(1)小明通过观察,认为废液中一定含有硫酸铜。他观察到的现象是。
(2)小红通过分析,认为废液中一定含有硫酸亚铁,她的依据是:
。
【作出猜想】小华认为废液中还可能含有硫酸。
【实验验证】(1)小华测得废液的pH小于7,证明废液中含有硫酸。用pH试纸测定溶液pH的方法:。
(2)小明取少量废液,向其中滴加氢氧化钠溶液,也得到了相同的结论。小明的实验现象是。通过分析与实验,同学们得出废液中含有硫酸亚铁、硫酸铜和硫酸。
【拓展应用】
(1)若将废液中的溶质全部转化为硫酸亚铁,应向废液中加入过量的。写出该反应过程中的一个化学方程式。
(2)反应完全后,过滤,滤渣中物质为,滤液中溶质为硫酸亚铁。
.(10扬州27). (15分)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润________。
【Na2CO3质量分数测定】
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体)。
(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
【NaN3纯度测定】精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
(10扬州26.) (10分)某研究性学习小组探究CuSO4溶液与NaOH溶液的反应产物。
(1)两溶液混合生成蓝色沉淀的化学方程式是_______。沉淀放置一段时间后,完全变为黑色沉淀,猜想是CuO。为验证猜想,将沉淀过滤、洗涤、烘干后,用CO还原得到红色物质,且生成的气体能使________,写出CO与CuO反应的化学方程式________。
(2)CuSO4溶液与NaOH溶液反应有时也会生成浅绿色沉淀 [化学式为CuSO4·3Cu(OH)2]和Na2SO4,则反应方程式为________。
(3)为探究新制Cu(OH),的分解温度,设计水浴加热装置(如图)。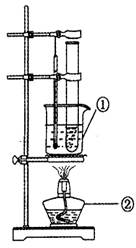
写出仪器的名称:①_______②_______。该装置采用水浴加热,其目的是_______。
(4)18℃时,将溶质质量分数均为10%的CuSO4溶液与NaOH溶液
混合后,测得混合液温度为22℃,说明该反应_____(填“放热”或“吸热”)。当水浴温度分别为30℃、60℃、90℃时,黑色沉淀出现的时间为:2分钟、6秒、1秒,则说明温度越高,Cu(OH)2分解速率越_____(填“快”或“慢”)。该实验说明,Cu(OH)2分解温度________(填“无确定数值”或 “有确定数值”)。
2010年5月12日,在苍茫海水中沉没了800多年的“南海一号”重见天日,其中的宋代铜钱已经锈迹斑斑.已知:铜绿的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它受热分解的化学方程式为:Cu2(OH)2CO3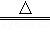 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
某同学设计了如下实验,用来测定碱式碳酸铜受热分解后产生的水和二氧化碳的质量比.
实验用到的主要装置为:
(1)装置连接顺序为: .(填写编号)
(2)操作步骤及数据处理:
第一步检查气密性;
第二步装入药品,称取装置①和③的质量;
第三步试验后再次称取装置①和③的质量,记录数据如表;
质装置 量 时间 |
装置① |
装置③ |
| 实验前 |
220.0克 |
195.0克 |
| 实验后 |
222.1克 |
199.4克 |
根据以上数据可得产生的水和二氧化碳的质量之比为 .(要求写出最简整数比)
(3)结果分析;从下列选项中选出产生该实验结果可能的原因有哪些? .
A.二氧化碳没有被完全吸收 B.水没有被完全吸收
C.碱式碳酸铜药品中含有水分 D.碱式碳酸铜没有完全分解.