市售“管道通”能使堵塞的管道畅通。小华通过实验对“管道通”中的物质成分进行了探究。
提出问题:“管道通”中含有什么物质?
查阅资料:
(1)下水管里的淤积物主要为油污、食物残渣、毛发等。
(2)氢氧化钠是强碱,能去除油污、腐蚀毛发等,可用于疏通管道。
(3)铝粉为银灰色固体,铝与酸、碱溶液都能反应放出氢气,并放出大量热。例如,铝与盐酸反应的化学方程式是: ,铝与氢氧化钠溶液反应的化学方程式是:2Al+2NaOH+ ═2NaAlO2+3H2↑
猜想与验证:小华打开一盒“管道通”,内有一袋白色固体颗粒和一袋银灰色粉末。
猜想Ⅰ:白色固体颗粒为氢氧化钠。实验方案如下表所示:
| 实验操作 |
实验现象 |
| ①将几粒白色固体颗粒放在表面皿上,放置一会儿 |
|
| ②将几粒白色固体颗粒放入盛有少量水的试管中,并用手触摸试管外壁 |
|
| ③向操作②得到的溶液中放入一段羊毛线,加热一段时间 |
羊毛线逐渐消失 |
结论:白色固体颗粒为氢氧化钠。
猜想Ⅱ:银灰色粉末为铝粉。
实验:取该粉末分别置于两支洁净的试管中,向一只试管中滴加稀盐酸,另一只中滴加 溶液,都产生大量气泡且试管外壁温度明显升高,点燃反应产生的气体火焰均呈淡蓝色。
结论:银灰色粉末为铝粉。
交流与反思:(1)老师告诉小华,氢氧化钾和氢氧化钠的性质非常相似.因此,要确认猜想Ⅰ是否正确,还需要学习如何检验钠元素的存在.
(2)使用管道通时,先将其中银灰色粉末添加于被堵塞的管道中,然后再加入白色固体颗粒,倒入一杯水后立即堵上管道口,管道内迅速发生反应.请写出一个使用“管道通”时的注意事项:
。
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术。他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。小蔡很感兴趣,于是他和同学们依据初中化学所学知识,进行如下实验探究:
【猜想】水与过氧化钠反应生成氧气并放出大量的热。
【实验探究】
实验一:探究水与过氧化钠反应有氧气生成并放出大量的热
(1)打开右图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生。检验有氧气生成的方法是是。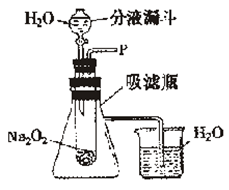
(2)能证明该反应能证明该反应放出大量热的实验现象是: 。
实验二:继续探究反应后生成的另一种物质是什么?
(3)小蔡取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的溶液呈 ______性,由此小蔡同学得出反应后生成的另一种物质是Na2CO3,你认为小蔡同学的结论________[填正确或不正确],理由是__________。
(4)由实验探究的结果,写出过氧化钠和水反应的化学方程式_________。
正确连接如下图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO。请回答下列问题:
(1)连接装置导管口的顺序:混合气体→(填导管接口代号)。装置乙分液漏斗中应加入。
(2)证明CO存在的有关反应的化学方程式是,。
(3)证明原混合气体中CO2存在的实验现象是。
(4)此实验不足之处是。
(7分)请你根据提供的实验仪器和药品参与实验室气体制备的研究与实践。实验仪器如下图所示(导管、橡皮塞等未画出):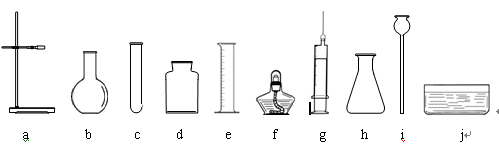
实验药品:二氧化锰、5%双氧水、大理石、稀盐酸、稀硫酸、高锰酸钾
【比较研究】 请填写下表
| 制取气体 |
反应物状态 |
反应条件 |
收集方法和依据 |
|
| 氧气 |
固体 |
加热 |
______集气法 |
O2不易溶于水 |
| 二氧化碳 |
__________ |
不需加热 |
向上排空气法 |
|
【实践研究】
(1)某同学选用a、c、d、f、j等组装制取和收集氧气的装置,该同学选用的药品是 。
(2)下列是该同学部分实验操作,其中不合理的是 。
A.先检查装置的气密性,后加药品 B.先固定试管,后放置酒精灯
C.先将导管伸入集气瓶,后加热试管 D.实验结束先熄灭酒精灯,后将导管移出水面
(3)四位同学根据提供的实验仪器分别设计了下列四套制取和收集二氧化碳的装置。
他们对设计的装置相互进行了交流评价。其中可能收集不到二氧化碳气体的装置是 ;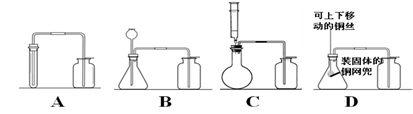
D装置能够使反应随时停止和发生,其中铜网兜换成铁制的后果是。
小明来到实验室时,发现实验桌上有五瓶敞口放置的NaOH溶液,他想这五瓶NaOH溶液一定变质了。请你用方程式表示变质的原理:。
其变质程度如何呢?
【提出猜想】小明猜想:这五瓶NaOH溶液可能全部变质了,也可能。
通过查资料,小明知道:CaCl2溶液和Na2CO3溶液发生复分解反应。
【实验探究】小明设计如下实验来验证自己的猜想,请根据表中内容填写表中有横线的格。
| 实验步骤 |
现象 |
结论 |
| 取第一个瓶中的NaOH溶液2毫升于试管中,滴加几滴酚酞试液。 |
由无色变红色 |
|
| 取第二个瓶中的NaOH溶液2毫升于试管中,滴加足量的CaCl2溶液。 |
白色沉淀 |
|
| 取第三个瓶中的NaOH溶液2毫升于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液。 |
NaOH溶液全部变质 |
|
| 取第四个瓶中的NaOH溶液2毫升于试管中,滴加几滴稀盐酸。 |
没有气泡放出 |
|
| 取第五个瓶中的NaOH溶液2毫升于试管中,滴加过量的稀盐酸。 |
(叙述整个过程出现的现象) |
部分变质 |
【拓展应用】保存NaOH溶液的方法是。
(1)小明在学习中体会到:检验CO2时总是用澄清石灰水,吸收CO2时总是用NaOH溶液。
实验探究:在体积相同盛满CO2的两集气瓶中,分别用注射器注入等体积的饱和石灰水和浓NaOH 溶液。实验装置和现象如图所示。
现象结论:根据甲装置中产生的实验现象,写出其中发生化学反应的方程式 ,解释通常用澄清石灰水而不用NaOH溶液检验CO2的原因;吸收CO2较多的装置是。
(2)计算验证:另一位同学小白进行了下列计算:
问题假设:有含a克Ca(OH)2的Ca(OH)2溶液和含a克NaOH的NaOH溶液各100g,分别通入CO2气体,生成CaCO3和Na2CO3时,两种溶液吸收CO2气体各多少克?
计算结果:Ca(OH)2溶液吸收了44a/74克CO2气体;NaOH溶液吸收了44a/80克CO2气体(小白想:我只是比较两个结果,可以不约分)
计算结果分析:含等质量溶质的Ca(OH)2溶液和NaOH溶液吸收CO2,Ca(OH)2溶液吸收的CO2的质量多。
结论:吸收CO2应该用饱和澄清石灰水。
思考评价:
小白的计算是否正确;
小白的计算结果分析是否正确:;
小白的结论是否正确:;理由:。
(3)现在由你来进行合理的计算验证,你的问题假设是:“相等的Ca(OH)2溶液和NaOH溶液,分别通入CO2气体,生成CaCO3和Na2CO3时,两种溶液吸收CO2气体各多少克?”
具体计算时,你还需要的数据是。