(15分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[xMg(OH)2•yMgCO3]
(2)为了确定产物成份(包括产生的气体、白色不溶物及溶液中溶质),进行以下定性实验。请填写表中空白:
| 实验序号 |
实 验 |
实验现象 |
结 论 |
| 实验Ⅱ |
将实验I中收集到的气体点燃 |
安静燃烧,火焰呈淡蓝色 |
气体成分为 ① |
| 实验Ⅲ |
将实验I中的白色不溶物滤出、洗涤,取少量加入足量 ② |
③ |
白色不溶物中含有MgCO3 |
| 实验Ⅳ |
取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 |
产生白色沉淀,溶液红色变浅 |
溶液中存在CO32-离子 |
(3)为进一步确定实验I中白色不溶物的成分,进行以下定量实验,装置如图所示: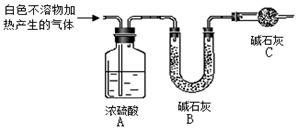
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
①装置C的作用是 ;
②白色不溶物的化学式为 。
(4)根据以上(2)及(3)的定性定量实验,写出镁与饱和碳酸氢钠溶液反应的化学方程式
__________________________________________________________________________。
(7分)用中和滴定法测定某烧碱样品的纯度。(锥形瓶中装待测液)
配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液。
(1) 滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视__________________________________。
滴定终点的现象是:________________________________
(2) 有关数据记录如下:
| 滴定序号 |
待测液体积(ml) |
所消耗盐酸标准液的体积(ml) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.55 |
| 2 |
20.00 |
6.00 |
25.95 |
纯度计算:烧碱样品的纯度为________________。
(3) 对几种假定情况的讨论:(填无影响、偏高、偏低)(说明:测定的结果指烧碱样品的纯度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果___________________
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果__________
③滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果__________。
FeCl3溶液中,加入难溶于水的CaCO3粉末,观察到CaCO3逐渐溶解,产生无色气体和红褐色沉淀。则:
(1)气体为,红褐色沉淀为
(2)上述现象产生的理由是(用离子方程式及简要文字表
在Na2CO3溶液中滴加酚酞显红色。
(3)溶液显红色的原因是(写离子方程式)
(4)将溶液加热观察到的现象为
(5)在溶液中加足量BaCl2溶液,观察到的现象为
(18分) 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。
| A.溶液显浅红色是因为Na2SO3水解呈酸性 | B.水解反应为放热反应 |
| C.水解反应为吸热反应 | D.升高温度,Na2SO3水解程度增大 |
第二组:该小组讨论Fe3+和SO32-之间发生怎样的反应,提出了三种假设:①是发生氧化还原反应:2Fe3++SO32-+ H2O = 2Fe2++ SO42-+ 2H+;②是发生双水解反应:2Fe3++ 3SO32-+ 6H2O = 2Fe(OH)3(胶体) + 3H2SO3;③是两种反应同时发生。为了验证假设,同学们进行了下列实验,请填写下列空白:
(1)用试管取适量Na2SO3溶液,加入BaCl2稀溶液,有白色沉淀生成,再加稀盐酸,沉淀全部溶解,然后再进行后续实验。该实验操作的目的是______________________。
(2)取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3溶液至过量,溶液颜色最终变为红褐色。这种红褐色液体是__________________。向红褐色液体中加足量盐酸,将所得溶液分成两份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为________________________;另一份加入BaCl2稀溶液,产生少量白色沉淀,白色沉淀为________(填化学式)。
(3)由上述实验现象说明假设__________(填编号)是正确的。
第三组:用0.1000mol/L的酸性KMnO4溶液滴定未知浓度的Na2SO3溶液,用碱式滴定管量取25.00mL Na2SO3溶液于锥形瓶,用_____式滴定管盛装KMnO4溶液进行滴定,滴定终点颜色变化为:_____色变为_____色;重复三次实验,测得消耗的KMnO4溶液体积平均值为20.00mL,则Na2SO3的浓度为____________mol/L。
(5分) 可用于分离或提纯物质的方法有:
| A.过滤 | B.萃取分液 | C.蒸馏法 | D.洗气法 E. 加热分解 |
下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填字母序号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用
(2)除去O2中少量的水蒸气,用
(3)提取碘水中的碘,用
(4)除去Na2CO3固体中的NaHCO3,用
(5)海水中提取淡水,用
有一包含有碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校同学在实验室进行如下实验。甲组实验方案:
在坩埚中称取样品3.0g →加热→冷却→称量→再加热?…(至恒重)。
①完成上述实验应该用到的玻璃仪器除酒精灯外还有____ ____。
②若坩埚质量为16.0g,加热至恒重时坩埚和残留物总质量为18.2g,则样品的纯度为_
(1)乙组:称取样品,利用下面的部分装置测得室温下样品与酸反应放出CO2的体积,计算样品的纯度(已知碳酸钠、碳酸氢钠与酸的反应都是放热反应)。
①完成该实验方案应选择的最佳装置是 __(用字母回答,下同)。
②该实验应选用的酸是__
a.稀盐酸b.稀硫酸c.稀硝酸d.三种酸均可。理由是________________________
(2)丙组中A同学根据 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
B同学对该实验方案提出质疑,丙组同学查阅了相关资料,并进行了如下实验:
室温下,取20 mL0.4 mol/L NaHCO3溶液置于烧杯中,向其中加入20 mL 2 mol/L CaCl2溶液,用玻璃棒搅拌。烧杯中出现白色沉淀,还有气泡产生。产生该现象的原因是_________ __ ___(用有关离子方程式解释)。
由此丙组同学共同讨论,否定了A同学的设计方案。