已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:
PbO2→Pb2O3→Pb3O4→PbO。
现将amol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
⑴ 试写出Pb2O3与浓盐酸反应的化学方程式__________________________
⑵ 通过计算确定y与a、x的函数关系式____________________
⑶ 若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为____;其物质的量之比为________________。
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,相关数据如下表所示。
| 溶质的物质的量浓度/mol·L-1 |
溶质的质量分数 |
溶液的密度/g·cm-3 |
|
| 硫酸 |
c1 |
w1 |
ρ1 |
| 氨水 |
c2 |
w2 |
ρ2 |
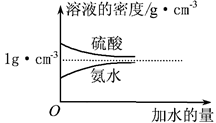
请根据表中信息,回答下列问题:
(1)表中硫酸的质量分数w1为________(不写单位,用含c1、ρ1的代数式表示);
(2)物质的量浓度为c1 mol·L-1,质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1,质量分数_______ w1/2 (填“>”、“<”或“=”);
(3) 质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_______ρ2 g·cm-3(填“>”、“<”或“=”);
(4)如果蒸发溶剂使硫酸的的质量分数变为2 w1,则所得硫酸的物质的量浓度 2 c1(填“>”、“<”或“=”)。
过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:2CaO2·XH2O  2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
现有0.270 kg质量分数为10﹪的CuCl2溶液。计算
(1)溶液中CuCl2的物质的量。
(2)溶液中Cl-的物质的量。
列式计算
(1)将标准状况下的HCl气体336 L溶于1.0L水中,所得盐酸密度为1.2g·cm-3,求该盐酸物质的量浓度。(保留三位有效数字)
(2)欲使100g10.4 % 的NaOH溶液溶质的质量分数增大到20%
① 需往溶液中加入多少克氢氧化钠?
② 若20%NaOH溶液的密度为1.066 g/cm3,计算物质的量浓度。(保留小数点后两位)
请根据化学方程式计算:
(1)完全中和0.3 mol氢氧化钠,需要硫酸的物质的量是多少?需要物质的量浓度为3 mol·L-1 稀硫酸多少升?(要求写出计算过程)
(2)质量分数为98%、密度为1.84 g·mL-1的浓硫酸的物质的量浓度是多少?若有此浓硫酸来稀释成3 mol·L-1稀硫酸,需要该浓硫酸多少毫升?(要求写出计算过程)