已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答:
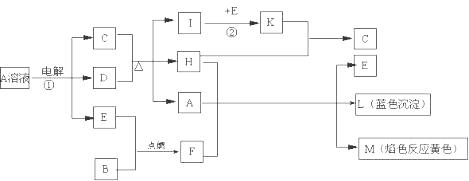
⑴L的化学式: F的电子式: 。
⑵反应①的离子方程式: 。
⑶反应②,工业上采取的反应条件: 。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
。
天然橡胶的结构简式为 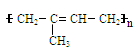 。盛放溴水的试剂瓶不能用
。盛放溴水的试剂瓶不能用
天然胶制的橡皮塞,其原因是
在化学反应中,铜元素可表现为0、+1、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜【即:曾青(CuSO4)跟铁反应就生成铜】。试写出该反应的化学方程式:。
(2)铜器表面有时会生成铜绿【Cu2(OH)2CO3】,这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的化学方程式:或。
(3)新制的铜试剂【Cu(OH)2】与葡萄糖反应会生成红色沉淀,因此该试剂可用于检验糖尿病人尿液中葡萄糖的含量。葡萄糖的结构简式如下: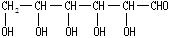 (简写为GCHO)
(简写为GCHO)
试写出GCHO与Cu(OH)2反应的化学方程式:。
有效地利用现有能源和开发新能源已受到各国的普遍重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能,如,加入CH3OC(CH3)3来生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间连接形式有________(填写编号)。
①C==O ②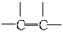 ③
③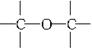 ④
④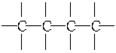
(2)天然气的燃烧产物无污染、热值高、管道输送方便,将成为我国西部开发的重点之一。天然气常和石油伴生,其主要成分是__________。能说明它是正四面体而非正方形平面结构的理由是__________(填写编号)。
①其一氯代物不存在同分异构体 ②其二氯代物不存在同分异构体
③碳原子与氢原子之间以共价键结合 ④四个碳氢键是完全等价的
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50 km·h-1行驶了40 km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下面可供开发又较经济的制氢方法是__________(填写编号)。
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得氢气后还需要解决的问题是________(写出其中一个)。
某学生称取9g直链淀粉溶于水,测定淀粉水解的百分率,其程序如下:
①各步所加试剂ABC
②只加A溶液,不加B溶液是否可以? 其理由是
③当析出2.16g金属单质时.淀粉的水解率是
蛋白质由氨基酸缩聚而成,蛋白质水解得多肽,多肽彻底水解得到氨基酸,科学家研究某多肽的分子式是C55H70N10O19将其彻底水解后只得到4种氨基酸:甘氨酸(C2H5NO2)、丙氨酸(C3H7NO2)、苯丙氨酸(C9H11NO2)、谷氨酸(C5H9NO4)
①这个“多肽”是肽。
②该多肽水解后,有个甘氨酸,有个丙氨酸,有个苯丙氨酸,有个谷氨酸。