浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样中的COD。主要的实验装置、仪器及具体操作步骤如下:
实验装置及仪器:
操作步骤:
①用仪器c将20.00mL水样置于250mL锥形瓶中,加入数粒碎瓷片。
②在水样中加入重铬酸钾标准溶液10.00mL,安装回流装置(如上图所示),从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应。
③冷却后加指示剂2d,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。
已知:Cr2O72—+14H++6Fe2+=6Fe3++2Cr3++7H2O
请你回答下列问题:
(1)仪器c的名称: ;用仪器c吸取液体时,左手拿洗耳球,右手将仪器c插入溶液中吸取,当 时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。
(2)下列有关操作不正确的是 (用相应编号填写)
A.用硫酸亚铁铵溶液滴定时需上述仪器中的仪器b
B. 仪器c在使用时需要先用待取液进行润洗,管尖残留的液体一般不要吹出
C.加入数粒碎瓷片的作用是可以防止液体暴沸
D.上述操作步骤③中在滴定时判断滴定终点的指示剂可以是甲基橙
E.加热回流结束后,要用蒸馏水对冷凝管管壁进行冲洗
(3)在加热回流过程中,可以用水浴作为恒温加热源吗?同时请说明理由。
(4)下列因素对测定水样中的COD能产生影响的有 (用相应编号填写)
①硫酸的用量 ②反应装置中的锥形瓶在反应前用蒸馏水洗涤
③重铬酸钾的用量 ④回流时间的长短
(5)实验室配制重铬酸钾标准溶液的主要步骤及装置如下所示: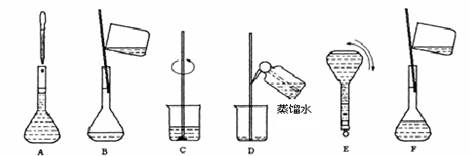
将上述实验步骤A到F按实验过程先后次序排列
(6)已知:重铬酸钾标准溶液的c(Cr2O72—)=0.0250mol·L—1,硫酸亚铁铵溶液的c(Fe2+)=0.0100 mol·L—1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为12.00mL,则按上述实验方法,测得的该水样的化学需氧量CODCr(O2)= mg/L
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响。设计实验方案如下:
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小。
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中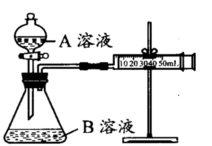
(注:实验中所用KMnO4溶液均已加人相同量H2SO4):
| 序号 |
A溶液 |
B溶液 |
| ① |
2 mL 0.1mol/LH2C2O4溶液 |
4 mL0.01mol/LKMnO4溶液 |
| ② |
2 mL 0.2mol/LH2C2O4溶液 |
4 mL0.01mol/LKMnO4溶液 |
(1)如何检查该装置的气密性:。
(2)写出当锥形瓶中加入A溶液后发生的反应的离子方程式(提示:H2C2O4为弱酸):。
(3)该实验探究的是对化学反应速率的影响。分析所给实验仪器,实现该实验目的还欠缺的仪器:。你将如何比较①②组化学反应速率大小?你的操作是。
乙组:通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢。
25℃时,40 mL 0.001mol/LKMnO4与38 mL0.1 mol/LH2C2O4和2 mL2.38mol/LH2SO4混合液共80 mL中KMnO4的浓度及对应时段的平均反应速率数据:
| 时间(min) |
4 |
8 |
12 |
16 |
21 |
22 |
23 |
24 |
25 |
| c(KMnO4)(10-4mol/L) |
4.58 |
4.02 |
3.36 |
2.25 |
0.72 |
0.43 |
0.23 |
0.16 |
0.13 |
| υ(KMnO4) (10-4mol/(L·min) |
υ |
0.14 |
0.17 |
0.28 |
0.32 |
0.29 |
0.20 |
0.07 |
0.03 |
(4)完成上表中υ=×10-4mol/(L·min)。
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大。
①你认为引起该反应速率增大的因素是。
②请设计实验证明你的观点,写出实验步骤及结论:
| 实验步骤及结论: |
(1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白。要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是:
a.干燥的氯气能否使试纸变白 b.水能否使试纸变白c.盐酸能否使试纸变白
(2)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。如图所示在试管中加入过量的块状碳酸钙.再加入约20ml饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去:过滤,将滤液滴在蓝色石蕊试纸上发现其漂白性比饱和氯水的更强:已知饱和氨水中存在Cl2+H2O H++C1-+HClO.反应后所得的溶液漂白性增强的原因是(用化学平衡移动原理解释)。
H++C1-+HClO.反应后所得的溶液漂白性增强的原因是(用化学平衡移动原理解释)。
(3)碳酸钙与氯水反应生成的含钙的化合物除氯化钙外,有人提出如下猜想
a.含次氯酸钙 b.含碳酸氢钙 c.含次氯酸钙和碳酸氢钙。
有人认为不可能含有次氯酸钙.他的理由可能是。
为了证明碳酸氢钙的存在,将滤液分为三份.分别进行以下实验:
①第一份与澄清石灰水混合,立即产生大量白色沉淀:此实验____(填“能”或“不能”)确证溶液中含有碳酸氢钙因为;
②第二份与稀盐酸混合,立即产生大量无色气体:
③将第三份加热,看到溶液变浑浊且有大量无色气体产生。反应的化学方程式为
④除上述实验外,你能设计的确证碳酸氢钙存在的实验方案是____。
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑问。久置KI固体被氧化变质,呈浅黄色(有I2),KI固体直接加热时,为什么不被氧化呢?因此,小组同学针对I-被氧化条件除了氧气之外还需要什么条件进行了实验探究。
【提出假设】根据久置KI固体会被氧化而变质,结合空气的成分,首先排除和稀有气体的影响。然后对KI变质条件提出合理假设:
假设一:需要H2O的参与;
假设二:需要CO2的参与;
假设三:。
【实验验证】
(1)为了验证假设二,小组同学设计了以下实验方案;取10mLKI溶液(浓度较大)于5支试管中,向试管中通入CO2气体或者滴加盐酸。一段时间后对比试管中的颜色深浅,之后向试管中滴入淀粉溶液,再次对比试管中的颜色深浅,具体实验现象见下表:
| 试管序号 |
1 |
2 |
3 |
4 |
5 |
| 通入CO2时间/min |
0 |
1 |
5 |
||
| 滴加盐酸/滴 |
0 |
3 |
6 |
||
| 溶液中颜色对比 |
无色 |
浅黄色→黄色(依次加深) |
|||
| 滴加淀粉溶液后的颜色对比 |
无色 |
浅蓝色→蓝色(依次加深) |
小组同学通过实验现象深入思考了CO2在反应过程中的作用,得出结论:CO2气体同盐酸一样在KI被氧化的过程中提供环境。
写出此实验中CO2与KI反应的化学方程式。
(2)为了验证I-被氧化是否必须要有H2O的参与,小组同学设计了以下实验验证:
| 实验步骤 |
预期现象和结论 |
| ①取一份纯净的KI固体,分成两等份; |
|
| ②一份加入到装有的集气瓶A中; 一份加入到装有的集气瓶A中; ③几天后观察。 |
【交流提高】
由于空气中CO2和水蒸气的含量很低,导致在加热KI的过程中这两种气体很容易被“驱散”,不能很好地与KI接触,KI自然就不能被氧化。长时间保存碘化钾需要避光、。
实验室可以用MgCl2•6H2O为原料制备碳酸镁晶须,主要流程如下:
试回答:
(1)操作1的名称是_______。
(2)上述反应过程要控制好温度,因为MgCO3置于水中长时间加热煮沸可完全生成Mg(OH)2,其原因是_____________________。
(3)另査阅文献,在加热煮沸时也可能生成碱式碳酸镁Mg5(OH)2(CO3)4·4H2O,写出该反应的化学方程式______________。
(4)某课题组为了确定MgCO3在水中长时间加热煮沸后所得的固体成分,进行如下研究。(注:Mg(OH)2, Mg5(OH)2(CO3)4.4H2O在煮沸时均不会分解)
①定性研究:请你完成下表中内容。
| 实验步骤 |
预期的实验现象和结论 |
| 取一定质量的固体样品 |
若 ,则固体产物为Mg(OH)2 |
②另取一定质量的固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?_______ (填“能”或“否”),理由是______________
亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案:
(1)无色气体B遇空气显红棕色,B的化学式为_______写出甲方案①中反应的离子方程式_______
(2)完成并配平乙方案①中反应的离子方程式
MnO4-+NO2-+=Mn2++NO3-+,
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、_______配制溶液时,定容的操作方法是______
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾溶液(过童)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中NaNO2的质量为_______mg.