(13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
| 族 周期 |
I A |
IIA |
IIIA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
| 二 |
|
|
|
① |
② |
|
③ |
|
| 三 |
|
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
| 四 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)在这些元素中,⑩原子的原子结构示意图为 。
(2)写出①的最高价氧化物和②的单质的电子式 , 。
(3)用电子式表示③与④形成化合物的过程 。
(4)①的单质和⑥的氧化物反应的化学方程式 。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出 kJ的热量。
下图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极。接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g。据此回答问题: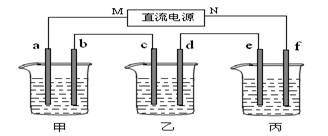
(1)电源的N端为极;
(2)电极b上发生的电极反应为;
(3)电极c上生成的气体在标准状态下的体积:;
(4)甲溶液的氢氧根离子浓度为(设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为,e电极的材料是:,f电极的电极反应式为。
工业上制取CuCl2的生产流程如下:
请结合下表数据,回答下列问题:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
⑴ 溶液A中加入NaClO的目的是;
此反应离子方程式为;
⑵ 在溶液B中加入CuO的作用是;
⑶ 操作a的目的是;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是。
25℃、1.01×105Pa时,氢硫酸饱和溶液的浓度为0.1mol·L-1,氢硫酸溶液呈酸性,用方程式表示主要原因。向溶液中加入少量Na2S晶体,振荡后溶液的pH将(填“增大”、“减小”或“不变”)。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、分液法 B、加热分解 C、结晶法 D、分液法 E、蒸馏法 F、过滤法
(1)分离饱和食盐水和沙子的混合物
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)分离水和汽油的混合物
(4)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶
用图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。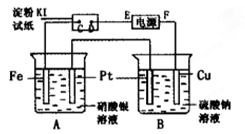
(1)E为电源的极(填“正”或“负”);
(2)A中发生反应的化学方程式为;
(3)在B中观察到的现象是;
(4)室温下,若从电解开始到结束,A、B装置中共 收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。
收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。