盐酸是实验室常用的重要试剂,请回答下列问题:
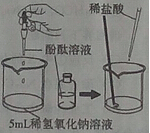
(1)为探究盐酸与氢氧化钠溶液的反应,设计下列实验方案:向
稀氢氧化钠溶液中滴加3滴酚酞溶液,然后逐滴加入稀盐酸,并用玻璃棒不断搅拌。
①实验过程中观察到的现象是
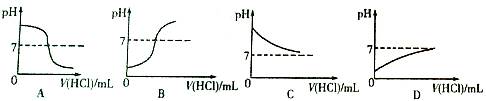
②向稀氢氧化钠溶液滴加稀盐酸至过量,溶液
变化的曲线正确的是
(2)实验室可以利用稀盐酸等药品,通过连接下图装置制取二氧化碳、氢气。
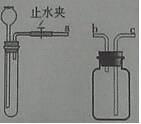
①制取二氧化碳气体装置的连接顺序是
②块状固体加入试管中的方法是
③检查发生装置气密性的方法是
(3分)已知元素周期表中第三周期各元素原子结构示意图如下:
请回答:
(1)在化学反应中,上述元素的原子中(填符号)容易失去电子。
(2)上述八种元素的原子都具有相同的_______________数。
(3)X和Y是上述元素中的某两种,它们能组成XY2型化合物,请写出这种化合物的化学式。
(5分)从①分子,②原子,③元素中选取适当的名词填空:
水是由氢和氧组成的。保持水的化学性质的最小粒子是水,这种粒子是由氢和氧构成的。
(3分)现有①四氧化三铁,②空气,③铁粉,④氯酸钾,⑤液态氧,⑥水,⑦氯化钾,⑧海水等物质,其中属于单质的是(填编号,下同);属于化合物的是 ,属于氧化物的是。
(4分)小刚利用家中废旧物品组装了一套简易灭火器
(如图Ⅰ所示),将瓶子倒转使两种物质混合即可灭火(如图Ⅱ所示)。利用该装罝灭火的原理是:小苏打和米醋(1)_____________________使瓶内压强增大,大于外界大气压,(2)______________,瓶内泡沫喷出附着在燃烧物表面,因为二氧化碳具有(3) ___________________的性质,使燃烧物(4)_________________,达到灭为的目的。
下图用“●”代表氢原子,“○”代表氧原子,这两种元素组成的化合物在一定条件下能发生以下反应,反应前后的微观模拟图如下: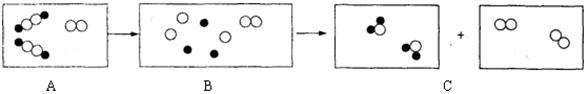
(1)在B中补充画出相关粒子图形,使其表示正确;
(2)补充的依据是。
(3)请写出此反应的微观实质;