(每空2分,16分)
Ⅰ.2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)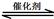 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行t1时刻达到平衡状态的是 (填代号)。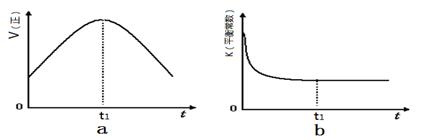
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H1=-867 kJ/mol ①
2NO2(g)  N2O4(g) △H2=-56.9 kJ/mol ②
N2O4(g) △H2=-56.9 kJ/mol ②
H2O(g) = H2O(l) ΔH3= -44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
Ⅱ.A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子符号);A、B、C三种元素按1:7:12的质量比组成的化合物中含有的化学键的类型属于 。
(2)某金属常用于制作易拉罐,该金属制作的废弃易拉罐能与 A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(3)A、C两元素的单质与烧碱溶液组成燃料电池,其负极反应式为 ,用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LA2时, 所得溶液在常温下的PH= (假设电解过程中溶液的体积不变) 。
某些有机化合物之间具有如下转化关系: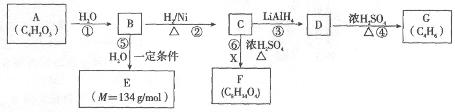
其中A是一种五元环状化合物,其分子中只有一种化学环境的氢原子;F核磁共振氢谱显示有三种化学环境的氢原子,且峰面积之比为2:2:3。
已知:①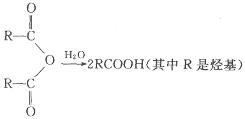
②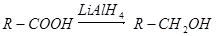 (其中R是烃基)
(其中R是烃基)
(1)G是合成顺丁橡胶的主要原料,G的名称是__________。B中含氧官能团的名称是__________。
(2)A的结构简式是__________。
(3)⑥的化学方程式是__________。
(4)E在一定条件下能够发生缩聚反应,其中主链上含“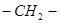 ”的高聚物的结构简式是__________。有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有__________种。
”的高聚物的结构简式是__________。有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有__________种。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量 、
、 等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(
等)制备聚铁(碱式硫酸铁的聚合物)和绿矾( ),其过程如下:
),其过程如下:
请回答下列问题:
(1)过程①中, 和
和 、
、 反应的化学方程式是______________。
反应的化学方程式是______________。
(2)过程②中产生的气体会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
a.浓 b.蒸馏水 c.
b.蒸馏水 c. 溶液 d.浓硝酸
溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是_____________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用天平称取样品 ;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为
;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为
 ,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
某化学兴趣小组对电化学问题进行了实验探究。
I 利用下图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应:_____________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成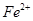 ;
;
假设2:铁参与反应,被氧化生成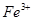 ;
;
假设3:__________________________。
(3)为了探究假设1、2,他进行如下操作:
①取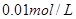
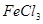 溶液
溶液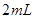 于试管中,加入过量铁粉;
于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴 溶液,未见蓝色沉淀生成;
溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴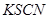 溶液,未见溶液变红。
溶液,未见溶液变红。
据②、③、④现象得出的结论是_____________。
II 利用下图装置做电解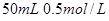 的
的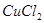 溶液实验。
溶液实验。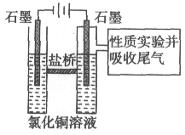
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的碘化钾淀粉试纸先变蓝后褪色(提示: 氧化性大于
氧化性大于 且含
且含 的溶液是无色的);
的溶液是无色的);
B.电解一段时间后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:①____________;②_____________。
(2)分析实验记录B中浅蓝色固体可能是_______________(写化学式),试分析生成该物质的原因___________。
 和
和 是两种重要的化工原料。
是两种重要的化工原料。
(1)在一定温度下,在固定体积的密闭容器中发生反应: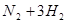

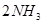 。该可逆反应达到化学平衡的标志是___________(填字母)。
。该可逆反应达到化学平衡的标志是___________(填字母)。
a.
b.单位时间生成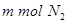 的同时消耗
的同时消耗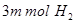
c.混合气体的密度不再随时间变化
d.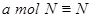 键断裂的同时,有
键断裂的同时,有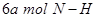 键断裂
键断裂
(2)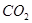 和
和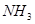 可用于合成尿素,原理分如下两步:
可用于合成尿素,原理分如下两步:
①合成氨基甲酸铵: △
△
②氨基甲酸铵分解: △
△ ,则2mol二氧化碳完全反应合成尿素的△H=_______。
,则2mol二氧化碳完全反应合成尿素的△H=_______。
(3)最近科学家们研制成功一种新型催化剂,能将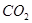 转变为甲烷。在常压、300℃,
转变为甲烷。在常压、300℃,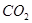 与
与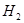 体积比为1:4时反应,
体积比为1:4时反应,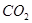 转化率达90%。
转化率达90%。
①此反应的化学方程式是_______________;
②一定条件下,某兴趣小组,在体积为VL的密闭容器中,模拟此反应达到化学平衡状态。该反应的平衡常数表达式为__________;由下图可知升高温度,K将__________(填“增大”、“减小”或“不变”);300℃时,从反应开始,到达到平衡,以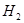 的浓度变化表示的化学反应速率是__________(用
的浓度变化表示的化学反应速率是__________(用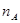 、
、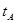 、V表示)。
、V表示)。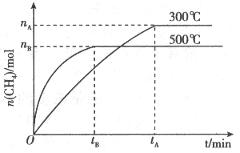
二氧化钛是一种重要的工业原料。
(1)实验室可通过以下方法制得: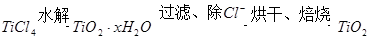
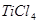 水解生成
水解生成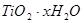 的化学方程式是_________;检验
的化学方程式是_________;检验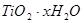 中
中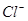 是否被除净的方法是_________。
是否被除净的方法是_________。
(2)工业上可用含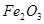 的钛铁矿(主要成分为
的钛铁矿(主要成分为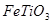 ,其中
,其中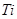 化合价为+4价)制取,其主要流程如下:
化合价为+4价)制取,其主要流程如下: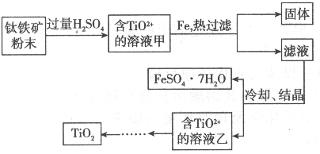
 与硫酸反应的离子方程式是________________;向甲溶液中加入铁的目的是________________。
与硫酸反应的离子方程式是________________;向甲溶液中加入铁的目的是________________。
(3)二氧化钛可用于制取金属钛,其步骤如下: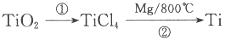
反应②的方程式是________________,该反应需要在 的气氛中进行,原因是________________。
的气氛中进行,原因是________________。