(每空2分,共14分)一化学兴趣小组的同学们对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取4g漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
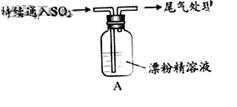 |
1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)C12和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象1的白雾由HC1小液滴形成。
①HC1的电子式是 。
②兴趣小组将A中产生的白雾引出导入硝酸酸化的硝酸银溶液中,结果有沉淀产生,有同学据此判断白雾确为HC1小液滴,试评价该结论的合理性并说明理由 。
(4)现象2中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象3中黄绿色褪去的原因: 。
(1)为鉴定硅产品中是否含有微量铁单质,将硅产品用稀盐酸溶解,取上层清液后需要加入的试剂是(填字母代号)
a.氯水b.NaOH溶液c.KSCN溶液d.Na2SO3溶液
(2)用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2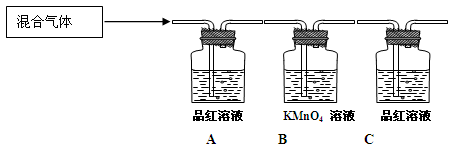
①可观察到A瓶溶液中的现象为。
②写出B瓶中的离子反应方程式为。
③C瓶溶液的作用是。
(3)取A、B两份物质的量浓度相等的NaOH溶液,体积均为50mL,分别向其中通入一定量的CO2后,再分别稀释为100mL。在稀释后的溶液中分别逐滴加入0.1mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示: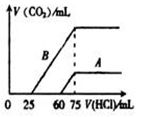
①A曲线表明,原NaOH溶液通入CO2后,所得溶液中的溶质的化学式为。
②对B曲线来说,写出横坐标上0~25 mL这一段反应的离子方程式。
按要求填写下列空白。
(1)高岭石一种硅酸盐矿物,其化学式为Al4Si4O10(OH)8,用氧化物的形式表示为。
(2)(6分,每空2分)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3)
②SO2(HCl)
③FeCl2(FeCl3)
(3)按照题目的要求写出化学反应方程式
①两种酸混合发生反应,酸性变弱:
②两种酸混合发生反应,酸性变强:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入5mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则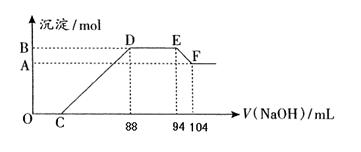
(1)B与A的差值为:mol
(2)DE段生成物的物质的量为:mol。
(3)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为:
(4)写出铝与该浓度硝酸反应的离子方程式:
某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、酸性KMnO4溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
(1)写出Na2O2与水反应的化学方程式 。
(2)试设计实验证明溶液X中含过氧化氢 。
(3)通过上述实验证明溶液中确实存在H2O2。 取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式: H2O2 + Fe2+ + OH-— Fe(OH)3¯,该反应中H2O2 表现了 性(填“氧化”或“还原”)
(4)已知溶液X可使酸性KMnO4溶液褪色,已知高锰酸钾产物为Mn2+,此时H2O2表现了 性(填“氧化”或“还原”)。该反应的离子方程式为
(1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是______,可能有的阳离子是。发生反应的离子方程式为;
(2)再向上述溶液中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为。若已知 a>c,则 c克滤渣是_________。