下列有关同分异构体数目的叙述中,正确的是
| A.C5H12有2种同分异构体 |
| B.C8Hl0中只有三种属于芳香烃的同分异构体 |
| C.CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 |
| D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
下列说法正确的是()
| A.为了节约应将实验过程中取用的剩余药品放回原试剂瓶 |
B.在汽车加油站见到的油罐车上所贴的危险化学品标志如下图所示: |
| C.闻化学药品的气味都不能使鼻子凑近药品 |
| D.实验结束后,可将含硫酸的废液倒入水池,用水冲入下水道 |
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知:
(1)步骤①中存在平衡:2Cr O42—(黄色)+2H+ Cr2O42—(橙色)+H2O
Cr2O42—(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH 一(aq)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在下列有关说法中,正确的是:()
| A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大 |
B.步骤①中当2v(CrO42 一)=v(Cr2O72—)时,说明反应2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O 达到平衡状态 Cr2O72—(橙色)+H2O 达到平衡状态 |
| C.步骤②中,若要还原1 mol Cr2O72一离子,需要12 mol(NH4)2Fe(SO4)2·6H2O。 |
| D.步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽 |
下列说法正确的是:()
A.反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1 2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1 |
| B.已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11。则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3 |
C.已知: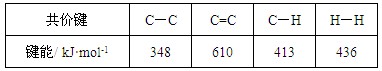 则反应 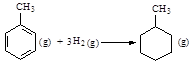 的焓变为ΔH = -384 kJ·mol-1 的焓变为ΔH = -384 kJ·mol-1 |
| D.一定浓度的NaOH溶液,温度升高PH值不变 |
下列说法正确的是:()
A.按系统命名法,有机物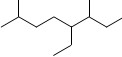 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 |
B.已知Ka是平衡常数,PKa=-lgKa 则下图所示有机物1mol最多能消耗3molNaOH 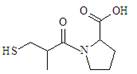 |
C. 分子中所有原子共平面 分子中所有原子共平面 |
| D.碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 |
如图是一种可充电的锂离子电池充、放电的工作示意图。放电时该电池的电极反应式为:
负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2)
下列有关说法正确的是:()
A.该电池的反应式为Li1-xMnO2+LixC6 LiMnO2+C6 LiMnO2+C6 |
| B.在整个充电或放电过程中都只存在一种形式的能量转化 |
| C.K与N相接时,Li+由A极区迁移到B极区 |
| D.K与M相接时,A是阳极,发生氧化反应 |