(10分)2,3二氢呋喃是抗肿瘤药物的中间体,也用于电子化学品和香料的生产中,可由丙烯为原料合成: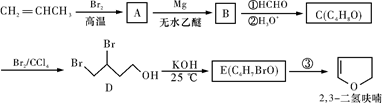
已知:①呋喃和四氢呋喃的结构简式分别为: 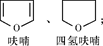
②卤代烃 R—X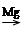 RMgX
RMgX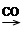 RCOMgX
RCOMgX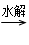 RCOH。
RCOH。
回答下列问题:
(1)呋喃、2,3二氢呋喃、四氢呋喃是否互为同系物? (填“是”或“否”)。
(2)用系统命名法命名化合物D: 。
(3)反应③的条件是________________。
(4)2,3二氢呋喃可转化为四氢呋喃,如何用简单的化学方法检验 2,3二氢呋喃是否完全转化? 。
(5)四氢呋喃还可由化合物C4H10O2在少量浓硫酸存在下制得,该反应的化学方程式为:____________。
(1)联氨(N2H4)是一种高能燃料。工业上可以利用氮气和氢气制备联氨。
已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1; 2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是。
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为。
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977。该氢化物受撞击后可完全分解为两种单质气体。该氢化物分解的化学方程式为。
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3===5N2十6H2O,6NO2+8NH3===7N2+12H2O。若尾气中NO和NO2共18 mol被氨水完全吸收后,产生了15.6 mol N2,则此尾气中NO与NO2的体积比为。
(1)室温下,Ksp(BaSO4)=1.1×10-10,将pH=9 的 Ba(OH)2溶液与 pH=4 的 H2SO4溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2溶液与 H2SO4溶液的体积比为。欲使溶液中c(SO42-)≤1.0×10-5mol·L-1,则应保持溶液中 c(Ba2+) ≥mol·L-1。
(2)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 molCH3COONa固体,则醋酸的电离平衡向(填“正”或“逆”)反应方向移动;溶液中 的值(填“增大”、“减小”或“不变”)。
的值(填“增大”、“减小”或“不变”)。
(3)已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5
b.CH3COOH+NaHCO3 = CH3COONa+CO2↑+H2O 室温下,CH3COONH4溶液呈性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈性。NH4HCO3溶液中物质的量浓度最大的离子是(填化学式)。
300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:
X(g) +Y(g) 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=
(2)能判断该反应已经达到平衡状态的是
A.生成X的速率是生成Z的速率的2倍
B.容器内压强保持不变
C.容器内气体的密度保持不变
D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是(任写一种)。
(4)温度为300℃时,该反应的化学平衡常数K=
(5)若起始时向该容器中充入X、Y、Z各0.20 mol,则反应将向(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比(填“增大”、“减小”或“不变”)
合理地开发和利用资源、能源,节能减排,保护环境,是人类社会可持续发展的基础。氢气是理想的能源之一,科学家最近研制出利用太阳能产生激光、并在二氧化钛( TiO2)表面使海水分解得到氢气的新技术。
(1)水分子分解时,断裂的化学键是H—O键,此时需要_______(填“放出”或“吸收”)能量。水分解生成氢气和氧气的反应属于__________(填“放热”或“吸热”)反应。
(2)氢气是理想的清洁燃料的原因主要有:一是其完全燃烧放出的热量是等质量汽油完成燃烧放出热量的3倍多,二是制取它的原料是水、资源不受限制,三是它______________,不会污染环境。
生物质含有葡萄糖、淀粉和纤维素等糖类,也称碳水化合物,绿色植物将二氧化碳和水变成碳水化合物的过程称为__________________。
(3)氢能开发的首要问题是研究如何以水为原料制取氢气。下列有关制取氢气的研究方向可行的是___________(填字母)。
a.组成水的氢、氧都是可燃的,可以研究在水不分解的情况下,使氢气成为燃料
b.寻找高效的催化剂,使水分解产生氢气,同时释放出热量
c.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
d.寻找更多的的化石燃料,利用其燃烧放热,使水分解产生氢气
(4)汽车或某些工业生产的尾气中含有的氮氧化物NOx(即NO和NO2的混合物),对生态环境和人类健康带来较大的威胁。
①大量的氮氧化物排放到空气中会导致的主要环境问题有形成酸雨、________(填—项)。
②已知在催化剂和加热条件下,NO与NH3反应的化学方程式为:6NO+4NH3 5N2+6H2O
5N2+6H2O
某研究小组按下列过程探究不同催化剂对NH3还原NO反应的催化性能:
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入滴有酚酞试液的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是_________________。
③工业上常用Na2CO3溶液吸收处理某些尾气中的NOx。己知:
NO不能直接与Na2CO3溶液反应;
NO+NO2+Na2CO3=2NaNO2+CO2;
2NO2+Na2CO3=NaNO2+NaNO3+CO2。
则当NOx被Na2CO3溶液完全吸收时,x的取值范围是_____________。
下表是元素同期表的一部分,表中每一序号分别代表一种元素。
(1)元素③位于第2周期、_____族,该元素属于_____(填“金属”或“非金属”)元素。
(2)元素④的最高价氧化物对应的水化物的化学式是________。元素②、⑦、⑧的最高价氧化物对应的水化物中,酸性最强的是___________(填物质名称)。
(3)表中所列8种元素中,原子半径最小的元素是________(填元素符号)。由⑤和⑧两种元素形成的化合物中,含有的化学键是_________(填“离子键”或“共价键”)。
(4)含有元素④的化合物在灼烧时,火焰的颜色为_________。元素⑤的单质在空气中燃烧时,会发生的现象有放热、产生大量的白烟和_________________。
(5)在元素②、⑥、⑦的最高价氧化物中,能够与水反应生成强酸的氧化物是_______(填化学式),能够用于制造耐火材料的物质是___________(填化学式)。
(6)只含有元素①、③、⑧的一种常见的盐的化学式是____________。