NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5% NO、1.5% NO2)用纯碱溶液完全吸收,得到NaNO2、NaNO3和Na2CO3的混合液及CO2气体。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到 NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0 t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1)第一步生产过程中发生反应的总化学方程式是 。
(2)检验NaNO3成品中是否含少量的Na2CO3杂质的方法是 。
(3)生产过程中Na2CO3的利用率是 (计算结果精确到小数点后两位)。
(4)生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积至少为 m3
(标准状况下)。
节能减排是当下环境保护的重点。
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g),△H<0
CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
①从起始经过5 min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)=;平衡时,容器中CO的转化率为。
②下图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的条件可能是。(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g) CO2(g)降低其浓度。
CO2(g)降低其浓度。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请在表中的空格处填写“>"“<”或“="。
②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为mol/L(请保留两位有效数字)。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为mol/L。
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(S)△H1="-" 74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2="-" 64.4kJ·mol-l
则:Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)的△H3=.
(2)某科研小组用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:
科研小组将MgCl2·6H2O在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。

①图中AB线段为“一段脱水”,试确定B点对应固体物质的化学式____;图中BC线段为“二段脱水”,在实验中通入H2和Cl2燃烧产物的目的是。
②该工艺中,可以循环使用的物质有___。
(3)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式。
(4)储氢材料Mg(AIH4)2在110~200℃的反应为:Mg(AIH4)2=MgH2+2Al+3H2↑;每转移3 mol电子生成Al的质量为____。
(5)“镁一次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为。
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
①能否各取少许固体用舌头品尝?____________。
②用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有_________性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下
已知:2NO2+2NaOH=NaNO2+NaNO3+H2 O
①写出装置I中发生反应的化学方程式____________________________。
②水_____________(选填“能"或“不能”)作为装置II中的试剂,理由是_____________。
③装置III中反应完全后,接下来的操作是____________________________。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_____(选填“增多”、“减少"或“不变”),原因可能是____________________________(用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从1000g刚煮熟的肉和1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗16.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2 O)
①滴定终点的判断依据为________________________________________________。
②隔夜熟肉中NaNO2的含量是____________mg/kg。
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
氢气是一种理想的“绿色能源”,下图为氢能产生与利用的途径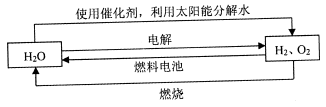
(1)上图中4个过程中能量转化形式有_____________
| A.2种 | B.3种 | C.4种 | D.4种以上 |
(2)电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解
2H2O(1) 2H2(g)+O2(g)△H1
2H2(g)+O2(g)△H1
2H2O(1) 2H2(g)+O2(g)△H2
2H2(g)+O2(g)△H2
以上反应的△H1_____________△H2 (选填“>"、“<”或“=”)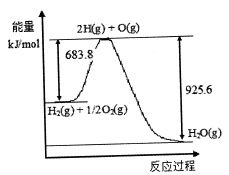
(3)已知H2 O(1)→H2 O(g)△H=" +44" mol·L-1,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式________________________________。
(4)氢能利用需要选择合适的储氢材料
①镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是__________________。
LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是__________________。
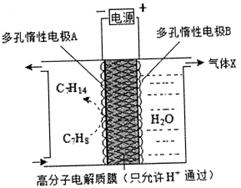
②一定条件下,如图所示装置可实现有机物的电化学储氢,总反应:2C7 H8+6 H2O(1) 2C7 H14+3O2 (g),电解过程中产生的气体X为_____,电极A发生的电极反应式为_________________。
2C7 H14+3O2 (g),电解过程中产生的气体X为_____,电极A发生的电极反应式为_________________。
湿法炼锌为现代炼锌的主要方法,下列是以硫化锌精矿为原料制备单质锌的工业流程。
(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为__________。
(2)浸出液以硫酸锌为主,还含有Fe3+、Fe2+、A13+、Cu2+、Cd2+、C1一等杂质,会影响锌的电解,必须除去。净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为______________________。
②将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用的试剂为_____(填字母)
| A.NaOH | B.NH3·H2 O | C.ZnO | D.H2 SO4 |
③用Zn除去Cu2+和Cd2+
④用Ag2SO4除去Cl一,发生的反应为Ag2SO4+2Cl一 2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。
2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。
(3)控制一定条件,用惰性电极电解硫酸锌溶液制取锌,锌在____极析出,阳极反应式为__________。