11分)铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: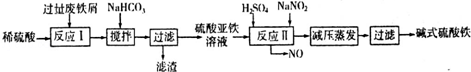
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式 .
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为 .
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为 g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为 .
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li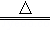 LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
A、B、C、D四种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的价电子排布为ns2πp2n,D在空气中燃烧可以得到淡黄色固体。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)D在元素周期表中的位置是。
(2)比较元素B和C的第一电离能:BC(填“大于”、“小于”或“不确定”),将BA3通入溴水中可发生反应,生成B的单质和一种盐Y,B的单质中的σ键和π键个数比为,盐Y的晶体类型是。
(3)D与A形成的粒子个数比为1:1的简单化合物可与水反应生成A的单质,该反应的化学方程式为。
(4)已知B2A4和过氧化氢混合可作火箭推进剂。12.8g液态B2A4与足量过氧化氢反应生成B的单质和气态水,放出256.65kJ的热量:
写出液态B2A4和氧气反应生成B的单质和液态A2C的热化学方程式。
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA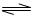 H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。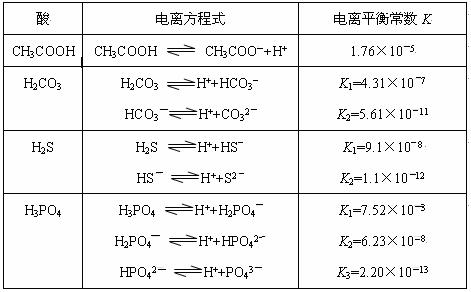
请回答下列各题:
(1)K只与温度有关,当温度升高时,K值______(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?_______________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_____________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律是K1:K2:K3≈1:10―5:10―10,产生此规律的原因是:________________________。
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式;
(2)PCl5分解生成PCl3和Cl2的热化学方程式;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是;
(4)P和Cl2分两步反应生成1mol PCl5的△H3=;P和Cl2一步反应生成1mol PCl5的△H4△H3 (填“大于”、“小于”或“等于”),原因是。
现有以下物质:①NaCl晶体, ②液态SO3, ③液态醋酸, ④汞,
⑤BaSO4固体,⑥蔗糖(C12H22O11),⑦酒精(C2H5OH),⑧熔融KNO3
请回答下列问题(填序号):
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是 ;
(3))以上物质中属于非电解质的是;
(4)以上物质中属于弱电解质的是;
以对甲酚(A)为起始原料,通过一系列反应合成有机物E的路线如下: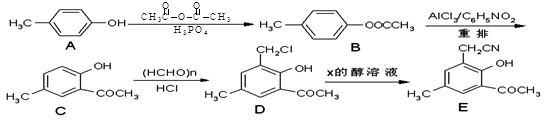
(1)A→B的反应类型为 。
(2)C的核磁共振氢谱有 个峰。
(3)D→E发生的取代反应中还生成了NaCl,则X的化学式为 。
(4)写出同时满足下列条件的D的同分异构体的结构简式: (任写一种)。
①苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种
②与Na2CO3溶液反应放出气体
(5)已知:R-CN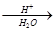 R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式: 。
R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式: 。
(6)利用合成E路线中的有关信息,写出以对甲酚、乙醇为主要原料制备 的合成路线流程图。
的合成路线流程图。
流程图示例如下: CH3CH2OH
CH3CH2OH  H2C=CH2 BrH2C-CH2Br
H2C=CH2 BrH2C-CH2Br