(1)铅蓄电池放电时发生下列反应负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,用该电池电解CuSO4溶液,当有纯铜1.6g析出时,铅蓄电池内消耗硫酸物质的量为_______。
(2)锌、溴蓄电池的充、放电的电池总反应为Zn+Br2  Zn2++2Br-。下列各反应①Zn-2e-====Zn2+ ②Br2+2e-====2Br- ③2Br--2e-====Br2 ④Zn2++2e-====Zn,其中充电时的阳极反应式为 ,放电时负极的反应式是 。
Zn2++2Br-。下列各反应①Zn-2e-====Zn2+ ②Br2+2e-====2Br- ③2Br--2e-====Br2 ④Zn2++2e-====Zn,其中充电时的阳极反应式为 ,放电时负极的反应式是 。
(3)目前人们正研究开发一种高能电池一—钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β,,——Al2O3陶瓷作固体电解质,反应如下:2Na+xS  Na2Sx,其正极反应式为 ,当外电路转移4mol电子时消耗硫单质的质量为 。
Na2Sx,其正极反应式为 ,当外电路转移4mol电子时消耗硫单质的质量为 。
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示: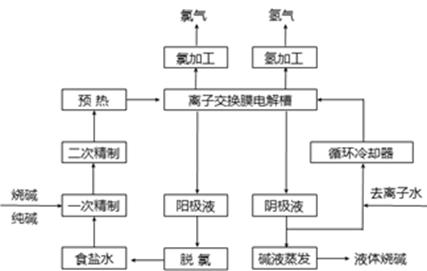
(1)该流程中可以循环的物质是。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式:,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果:。
(3)下图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是,E电极的名称是。电解总反应的离子方程式为。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为。
Ⅰ、已知:C(s)+H2O(g) CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100 kPa |
4.56 |
5.14 |
5.87 |
6.30 |
7.24 |
8.16 |
8.18 |
8.20 |
8.20 |
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态。
A.混合气体的密度不再发生改变
B.消耗1 mol H2O(g)的同时生成1 mol H2
C.混合气体的总体积
D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=mol;
Ⅱ、根据最新“人工固氮”的报道,在常温、常压、光照条件下,N2在催化剂表面可与水发生反应生成NH3,反应方程式:2N2(g)+ 6H2O(l) 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
(1)该反应的△H_____O, △S____0(填“>,<,=”)
(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1_______K2(选填“>,<,=”)
(3)与目前广泛应用的工业合氨相比,该方法的固氮速率慢,氨的生成浓度低,有人提出在常压、450℃下进行该反应,效率将更高,科学家认为该方案不可行,理由是__________.
Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。
试分析:
①B曲线代表(用微粒符号表示)分数变化;滴加过程中,溶液中一定成立:c(Na+)=。
②M点,溶液中主要涉及的离子方程式:。
根据题给信息,完成下列各小题:
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10—4mol/L,c(SO42—)=2.5×10—4mol/L,c(Cl—)=1.6×10—5mol/L,c(NO3—)=1.4×10—5mol/L,c(Ca2+)=1.5×10—5mol/L,则该废水的pH为________。
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为______________________。
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸__________(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=__________mol·L-1。
(3)②组情况表明,c__________0.2 mol/L(选填“大于”、“小于”或“等于”)。
混合液中离子浓度c(A-)与c(Na+)的大小关系是___________。
(4)从③组实验结果分析,说明HA的电离程度__________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是__________。
(共10分前2个空每空一个1分,其余每空2分)、
依据氧化还原反应2Ag+(aq)+Cu(s) ="===" Cu2+(aq)+2Ag(s)设计的原电池如图所示: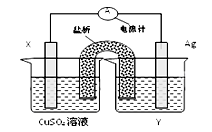
请回答下列问题:
(1)外电路中的电子是从_______ 电极流向________电极。
(2)银电极发生的电极反应为________________________;
X电极上发生的电极反应为____________________________;
(3)LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2==="4LiCl" +S +SO2↑。请回答下列问题:
写出电池的负极发生的电极反应为____________________________________;
电池正极发生的电极反应为____________________________________
(10分,每空2分)现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的比值将__________(填“增大”、“减小”或“无法确定”)。
的比值将__________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙) (填“大于”、“小于”或“等于”)。
(3)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)。(填“大于”、“小于”或“等于”)。
(4)室温下,现有pH=2的醋酸溶液与PH=12的氨水,等体积混合后,溶液呈中性,则溶液中离子浓度的大小关系:______________