向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应: xA(g)+yB(g)  pC(g)+qD(g)已知:平均反应速率VC=VA/2;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。回答下列问题:
pC(g)+qD(g)已知:平均反应速率VC=VA/2;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。回答下列问题:
(1)反应2min内,VA = ;
(2)化学方程式中,x= 、y= 、p= 、q= ;
(3)如果其他条件不变,将容器的容积变为 1L,进行同样的实验,则与上述反应比较:
①反应速率 (填“增大”、“减小”或“不变”)
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由 是 ;
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸和浓硝酸的混合酸加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50℃~60℃下发生反应。
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后用蒸馏水洗涤。
⑤将用无水氯化钙于燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
(1)配制一定比例浓硝酸和浓硫酸混合酸时,操作注意事项是;
(2)步骤③的加热方式是;
(3)步骤④中,洗涤、分离粗硝基苯应使用的仪器是;
(4)步骤④中,粗产品用5%的NaOH溶液洗涤的目的是;
(5)现有三种实验装置,如下图所示,要制备硝基苯,应选用()
(1)“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如右图所示: “立方烷”的分子式是_________________;该立方烷的二氯代物具有同分异构体的数目是___________________。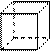
(2)写出分子式为C4H10O属于醇类的可能结构简式并命名:_________________
。
苯环上原有取代基对苯环上再导入另外取代基的位置有一定影响。其规律是:
(1)苯环上新导入的取代基的位置主要决定于原有取代基的性质;
(2)可以把原有取代基分为两类:
①原取代基使新导入的取代基进入苯环的邻、对位;如:-OH、-CH3(或烃基)、-Cl、-Br等;②原取代基使新导入的取代基进入苯环的间位,如:-NO2、-SO3H、-CHO等。
现有下列变化:(反应过程中每步只能引进一个新的取代基)
 |
(1)请写出其中一些主要有机物的结构简式:
A B C D E
(2)写出①②两步反应方程式:① ,
② 。
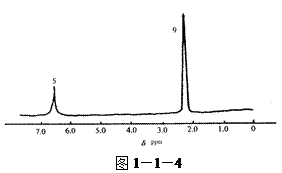
由分子式及核磁共振氢谱写出该有机物的结构简式(图1—1—3)、(图1—1—4)
|
|
 |
|||
 |
|||
答案(1)
(2)
①结构简式:________________________ ②结构简式:________________________
在所给反应条件下,推断下列各步反应所得有机物的结构简式: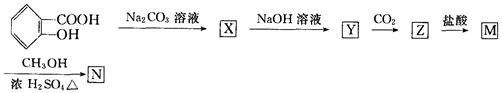
X____________Y____________Z_____________M______________N____________。