下图是一个电化学过程的示意图。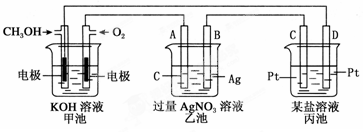
请回答下列问题:
(1)图中乙池是 (填“原电池”“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”“负极”“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式: 。
(4)乙池中反应的化学方程式为 ,当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中 电极(填“C”或“D”)析出1.6 g某金属,则丙池中的某盐溶液可能是________。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
(6分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学 化学知识回答下列问题:
化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序___。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)浓度为0.1mol/L的(NH4)2Fe(SO4)2溶液与(1)相比c(NH4+)中的大(填化学式)
(10分)如表是不同温度下水的离子积数据:试回答以下问题:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
KW |
1×10-12 |
(1)若25<t1<t2,则KW___1×10-14(填“>”、“<”或“=”),作出此判断的理由是__。
(2)25℃下,某Na2SO4溶液中c(SO)=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+):c(OH-)=__________。
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1:V2=_______。此溶液中各种离子的浓度由大到小的排列顺序是___________。
(12分)已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是____,溶液中c(H+)____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为______,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质____。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH)__________c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)__________c(H+)(填“>”,“=”或“<”)。
(4分)化学上常用电离度表示电解质的相对强弱:α=已电离的电解质分子数/溶液中原有电解质的总分子数×100%。
| 物质(微粒)及编号 |
电离度α |
| A.硫酸溶液(第一步完全电离): HSO  H++SO H++SO |
10% |
B.硫酸氢钠溶液:HSO H++SO H++SO |
29% |
CH3 COOH COOH CH3COO-+H+ CH3COO-+H+ |
1.33% |
| D.盐酸:HCl=H++Cl- |
100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是_____(填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO的电离度小于相同温度下0.1 mol·L-1硫酸氢钠溶液中HSO的电离度,其原因是__________________。
在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)==c(M+),而乙同学认为c(A-)与 c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为同学的说法正确,理由是。