部分难溶物的颜色和常温下的Ksp如下表所示:
| |
Cu(OH)2 |
CuOH |
CuCl |
Cu2O |
| 颜色 |
蓝色 |
黄色 |
白色 |
砖红色 |
| Ksp(25 ℃) |
1.6×10-19 |
1.0×10-14 |
1.2×10-6 |
— |

某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ 装置如图所示,接通电源后,发现a、b电极上均有气泡产生。
(1)电解过程中的总离子反应方程式为_________________________________________。
(2)为了确定电源的正、负极,下列操作一定行之有效的是 。
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ 把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示。
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色。
(3) a极发生的电极反应方程式为________________________________________________________。
(4) 电解5 min后,b极发生的电极反应方程式为___________________________________________。
(5)12 min后,b极附近出现的橙黄色沉淀的成分是 ,原因是___________________________________________________________________________________。
在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)一定条件下,能说明该反应达到化学平衡状态的是 (填字母)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得 c(CO) =" 0.0080" mol﹒L-1 ,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(1)用金属钠制取过氧化钠的化学方程式是 ,现象是 。
(2)已知用金属钠生成氧化钠,有多种方法:
①4Na+O2===2Na2O ②4Na+CO2===2Na2O+C
③2NaNO2+6Na===4Na2O+N2↑
在上述三种方法中最好的方法是 ,原因是 。
(3)如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气。过一段时间后可观察到 ,发生反应的化学方程式为 。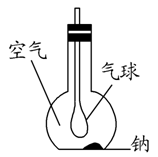
分析下列氧化还原反应中化合价变化的关系,用双线桥法标出电子转移的方向和数目,并指出氧化剂和还原剂。
(1)Fe+H2SO4=FeSO4+H2↑;氧化剂是 ;还原剂 。
(2)2KMnO4+16HCl(浓) =5Cl2↑+2MnCl2+2KCl +8H2O;氧化产物是 ;还原产物是 。
(现有下列6种物质:①稀豆浆 ②K2CO3溶液③Cl2④SO2⑤稀盐酸 ⑥氢氧化钠。其中属于胶体的是 (填序号、下同),属于非电解质的是 ,属于单质的是 ,属于电解质的是 。KHCO3的电离方程式是 。
下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是: 。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为: 。