X、Y、Z、W、Q、R均为前4周期元素,且原子序数依次增大。其相关信息如表所示:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y原子的2p轨道中有3个未成对电子 |
| Z元素的族序数是其周期数的3倍 |
| W原子的第一至第四电离能分别为: I1=578 kJ·mol-1 I2=1 817 kJ·mol-1 I3=2 745 kJ·mol-1 I4=11 575 kJ·mol-1 |
| Q为前4周期中电负性最小的元素 |
| 元素R位于周期表的第11列 |
请回答下列问题:
(1)Y3-的原子结构示意图为___________________,Y的氢化物的空间构型为______________。
快速制备Y的氢化物可用Y的氢化物的浓溶液与NaOH固体的原因_________________。
(2)已知YZ2+与XZ2互为等电子体,写出YZ2+的电子式____________________。
(3)R的基态原子价电子排布式为______________________,R的氯化物的水溶液与Q单质发生反应的离子方程式为____________________________________________________。
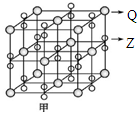
(4)化合物甲由Z、Q两种元素组成,其晶胞如图,甲的化学式为
________________。
(5)已知由X形成的自然界硬度最大的单质完全燃烧的燃烧热
为395 kJ/mol。且1 mol Z=Z键完全断裂时吸收热量497 kJ,1 mol
X=Z键形成时放出热量745 kJ,则单质X中1 mol X—X键断裂时吸收热量为___________________。
重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。这说明铁离子具有性,上述反应中维生素C是_____剂。
(2)给下列方程式配平,用双线桥标电子转移方向和数目
MnO2 +HCl(浓) = MnCl2 + Cl2↑ +H2O
当发生转移的电子物质的量1摩时,被氧化的HCl物质的量。
(7分). 某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D 反应能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C,D,E。
(2)写出下列反应的化学方程式:
①A和水生成E:
②B和D生成C:
(1)0.5 mol H2O的质量为________,其中共含有________个原子(用阿伏伽德罗常数表示)。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是_____(填分子式,下同),在相同温度和相同压强条件下,体积最大的是_____。
(3)在_____mL 0.2 mol/L NaOH溶液中含1 g溶质;配制500 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O________g。
(4) 现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸________ml
节假日双休日,去野炊实为一大快事。然而,在野炊的情趣之中,如果遇到下面一些问题,你该如何处理?
(1)对野炊有经验的人会告诉你,餐具最好是导热性好,不易破碎的材料制成,你准备带的餐具是用制成的;(填字母)
A.金属B.陶瓷C.无所谓
(2)野炊食谱如下:主食:馒头配菜:红烧肉、豆腐汤、牛肉干。主食和配菜中主要含蛋白质、、油脂、无机盐和水等营养素。
(3)用高锰酸钾制氧气时,收集到的氧气略显红色,可能的错误操作是________ ____。
(4)用水将pH试纸润湿后,再测某稀盐酸的pH,结果_________________(填“偏大”、“偏小”或“无影响”)。
(5)“低碳生活”是指生活作息时所耗用的能量要尽量少,减低二氧化碳排放量,从而减少大气污染,保护环境。下列做法符合“低碳生活”理念的是(填序号)。
①节约使用天然气②提倡使用一次性木筷③大量砍伐森林树木
一些老式建筑的下水道都是铁管铺设的,若将实验室的废盐酸倒入下水道将会发生反应(写化学方程式,下同),
导致铁管腐蚀;农药波尔多液中含有CuSO4,所以这种农药不能用铁制品盛装,否则会发反应 而使铁制品腐蚀;
而使铁制品腐蚀;
热水 瓶胆上水垢的主要成分是Mg(OH)2和CaCO3两种物质,在实验室除去它们最好选择的反应是
瓶胆上水垢的主要成分是Mg(OH)2和CaCO3两种物质,在实验室除去它们最好选择的反应是