CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。目前,人们利用光能和催化剂,可将CO2和H2O(g)转化为CH4和O2。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入l L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内CH4的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入l L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内CH4的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知: CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式 。
②该反应的△S 0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是 (填字母);理由是 。列式计算270℃时该反应的平衡常数K: 。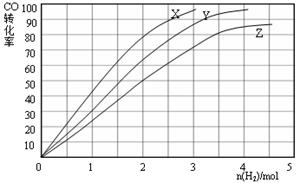
(4)以燃料电池为工作原理测定CO的浓度,其装置如图所示,
该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。则负极的反应式 。
关于该电池的下列说法,正确的是 。
A.工作时电极b作正极,O2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中CO的含量越高
已知: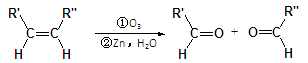
某一元氯代烃A分子式为C6H11Cl,可以发生如下图所示的转化: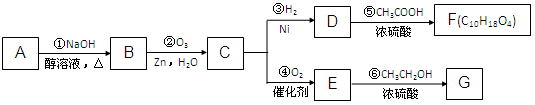
结构分析表明F分子中含有两个甲基。请回答下列问题:
(1)G的分子式为_____________。
(2)写结构简式:A___________________,E______________________。
(3)A→B的反应方程式是_________________________________________。
D → F的反应方程式是_________________________________________。
(4)F 和 G____________(能或不能)互称为同分异构体。
(5)分子式和E相同,主链含有3个碳原子的二元羧酸的同分异构体有_______种。
(11分)已知短周期元素X、W、Z、Y核电荷数依次增大。X为原子半径最小的元素,W的最外层电子数是次外层的二倍,Y的最外层电子数为电子层数的三倍。
(1)写出Z单质的电子式_______________________
(2)由X、W、Z三种元素可组成火箭燃料甲,三种元素质量比为2∶6∶7,甲蒸气密度是同温同压下氢气密度的30倍,甲分子式________。Z、Y可形成多种化合物,其中化合物乙Z2Y4可做为火箭燃料燃烧时的供氧剂。虽然化合物甲与乙都有毒,但燃烧产物却无毒。写出化合物甲与乙反应的化学方程式:________________________
该反应生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
(3)X、Y两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。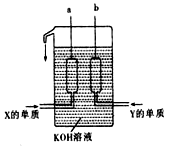
①b是电池的_____________极,a电极上的电极反应式是_________________________,消耗n molY单质时电池内转移的电子个数约为_______________。
②如果燃料电池中,a电极上改为通入X与W两种元素形成的化合物丙(其它条件不变)写出b电极上的电极反应式是_________________________________。
③如果只把燃料电池电解质改为掺入了三氧化二釔的ZrO2晶体,它在高温下传导O2-(其它条件不变),电池工作时,固体电解质里的O2-向____________极(填a或b)移动,正极反应式为________________________。
(9分) (1)下列反应能设计成化学能转化为电能的装置是
A Zn+CuSO4=ZnSO4+Cu B NaOH+HCl=NaCl+H2O
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式:
正极反应 负极反应 .
(3)某烷烃的蒸气质量是相同条件下氢气质量的36倍,该烃的分子式为____________,请写出该烃同分异构体中有4种不同沸点的一氯代物的该烃的结构简式,并命名:
、
(10分)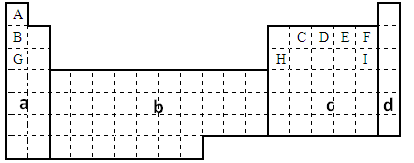
(1)在上面元素周期表中全部是金属元素的区域为___________。
| A.a | B.b | C.c | D.d |
(2)G元素单质在E元素单质中燃烧时形成的化合物的化学式是______,它是__________(填“共价化合物”或“离子化合物”)。该化合物含有的化学键类型是;
该化合物的电子式是。
(3)表格中九种元素能形成最高价氧化物对应的水化物中,碱性最强的是________(用化合物的化学式表示,下同),酸性最强的是__________,属于两性氢氧化物的是__________。
(4)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 ________(填名称),可以验证该结论的实验是_______。(填编号)
a将在空气中放置已久的这两种元素的块状单质分别放入热水中;
b将这两种元素的单质粉末分别和同浓度的盐酸反应;
c将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液;
d比较这两种元素的气态氢化物的稳定性。
以下都是我们生活、学习中常见的物质,请按照要求回答相关问题:
①干冰 ②氧化钙 ③墨水 ④大理石 ⑤盐酸 ⑥硝酸 ⑦澄清石灰水
⑧氯化钙溶液 ⑨氯化银沉淀 ⑩有尘埃的空气 ⑾硝酸银溶液
⑿稀豆浆 ⒀纯碱溶液 ⒁水 ⒂Ca(NO3)2溶液
(1)属于氧化物的是________________(2)能发生丁达尔效应的是_____________
(3)属于电解质的是________________(4)属于非电解质的是_________________
(5)根据酸、碱、盐、氧化物相关知识,结合下图物质之间的转化关系,完成以下问题,已知物质A、B、C、D、E的组成中均含有一种相同元素,①②③④⑤⑥代表反应序号,且物质A是一种氧化物,E难溶于水,以下转化反应中所有反应物、生成物均来自于上述15种物质或其溶液。
a)要实现如图所示的各物质之间的变化,用到次数最多的试剂是 ____(填试剂名称)
b)写出符合反应⑤的一个化学方程式__________________________________________
c)写出反应②的离子反应方程式______________________________________________
反应⑥的离子反应方程式__________________________________________________
d)上述6个反应从类型上看,有一个与其他5个不相同,它是反应__________(填反应序号)。