某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)="4.5" mol·L-1,反应均需要搅拌60min。
| 编号 |
温度/℃ |
加入某盐 |
H2SO4体积/mL |
H2O体积/mL |
铝粉加入量/g |
铝粉溶解量 /g |
| ① |
20 |
不加 |
40 |
0 |
2.0050 |
0.0307 |
| ② |
80 |
不加 |
40 |
0 |
2.0050 |
0.1184 |
| ③ |
t1 |
不加 |
20 |
V1 |
2.0050 |
﹨ |
| ④ |
t2 |
5 mL0.01 mol·L-1 CuSO4溶液 |
20 |
V2 |
2.0050 |
﹨ |
(1)实验①和②的目的是 。
为了获得铝粉溶解量,还需要测量的数据是 。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1= ℃,V1= mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2= ℃,V2= mL。
研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是 。
某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1:____________________________________;
猜想2:____________________________________;
猜想3:____________________________________。
为了验证猜想,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入,则: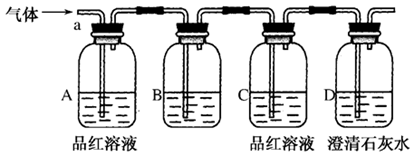
(1)B中应该装下列________试剂(填编号)。
| A.NaCl溶液 | B.酸性KMnO4溶液 | C.盐酸 | D.澄清石灰水 |
(2)A中品红溶液的作用是:
_____________________________________________。
(3)D中澄清石灰水的作用是:
_________________________________________________。
通过该实验,该小组同学观察到以下三个实验现象:①A中品红溶液褪色,②C中品红溶液不褪色③D中澄清石灰水变浑浊
【得出结论】
(4)由上述现象该小组同学确认该气体的成分为:_______________。
某石灰石块状样品中含有不溶于酸的杂质,拟用下图所示装置测定其中CaCO3的质量分数。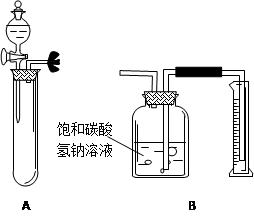
回答下列问题:
(1)写出检验A装置气密性的一种简单操作方法。
(2)将样品加入试管A的正确方法是。
(3)用托盘天平称取样品Wg,若所用天平游码标尺最大量程为5g,则与此天平配套的砝码中最小的砝码质量(选填编号字母)。
A.1g B.2g C.5g D.10g
(4)在读取量筒内液面读数时应注意(选填编号字母)。
A.视线与凹液面最低处相平 B. 视线与凹液面弧线相切
C.读数时应使广口瓶内液面与量筒内液面相平
D. 读数时不一定使广口瓶内液面与量筒内液面相平
学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
Ⅰ.实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾 Ⅱ. 实验步骤:略
Ⅲ. 实验数据:
| 实验编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
| 化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
| 1 |
0.60 |
- |
- |
- |
10 |
480 |
| 2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
| 3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
| 4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
| 5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
Ⅳ. 实验讨论:
(1) 在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、_________、________
(2)实验编号3的实验中KClO3的分解率为_________________%(保留一位小数)
(3) 在用Cr2O3做研究实验时,发现有黄绿色刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用_______________试纸检验。上述异常现象产生的原因是______________________________________。
Ⅴ.实验结论:________________________________________________________。
某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag,称量时应该使用的主要仪器的名称是。
(2)将样品溶解于足量的稀盐酸,过滤。滤液中主要含有,滤渣中含有,溶解、过滤用到的玻璃仪器是,如果这一实验在月球上完成,它比在地球上做要(填“容易”或“难”)。
(3)滤液中加过量的氢氧化钠溶液,过滤,有关反应的离子方程式为。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤,有关反应的离子方程式为。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称重,其质量为b g,原样品中铝的质量分数是。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果(填“偏高”、“偏低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果,若滤渣灼烧不充分,则实验结果。
在一个小烧杯里,加入20gBa(OH)2.H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上。然后加入10gNH4Cl晶体,并立即用玻璃棒搅拌。
(1)试验中玻璃棒的作用是。
(2)写出有关反应的方程式,该反应属于反应。
(3)实验中观察到的现象有,和反应混合物成糊状。反应混合物呈糊状的原因是。
(4)通过现象,说明该反应为热反应,这是由于反应物的总能量生成物的总能量。