向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴(1滴约0.05mL)2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是 。
如右图,a、b是石墨电极,Z是滴有酚酞的饱和氯化钠溶液,通电一段时间后,在a棒附近看到颜色变红明显,则电源y是极,实验过程中还能观察到的现象是
,a棒发生的电极反应式为,b棒电极反应式为。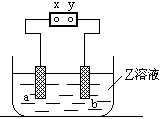
(10分)在密闭容器里,通入x mol H2(g)和y molI2(g),发生反应
H2(g)+I2(g) 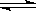 2HI(g)△H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2HI(g)△H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度;(2)扩大容器的体积;
(3)充入更多的H2;(4)容器容积不变,通入氖气;
(1)Zn∣H2SO4溶液∣C原电池:负极反应
正极反应;电池反应
(2)H2∣KOH溶液∣O2原电池:负极反应
正极反应;电池反应
在101kPa时,0.5molCH4完全燃烧生成CO2和液态H2O放出495.2kJ的热量,写出该反应的热化学方程式。.
100mL浓度为2mol•L-1的硫酸与过量锌粒反应,为加快反应速率,又不影响生成氢气的总量,可采取的方法是。
| A.加入适量的6mol•L-1的硫酸 | B.将锌粒改为锌粉 | C.加入适量的KCl溶液 | D.升高溶液温度E.加入适量硫酸铜 |