(Ⅰ)如图所示:
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀。请写出正极反应式 。
(2)若开始时开关K与b连接时,两极均有气体产生,则N端是电源的 极(填正或负)则总反应的离子方程式为 。
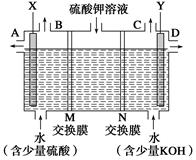
(Ⅱ)用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的_____(填“正”或“负”)极相连,氢气从_____(填“A、B、C或D”)口导出。
(2)已知离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”)交换膜。
(3)若制得标准状况下5.6 L氧气,则生成氢氧化钾的质量是____________。
铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是______________________。
(2)若将1中的反应设计成原电池,请画出原电池的装置图__________________(标出正、负极材料及电解质溶液),并写出电极反应式。
正极反应________________,负极反应__________________。
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显。请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种水可任选,设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式①_____________________________
②_____________________________。
劣质不锈钢腐蚀的实验现象_____________________________。
(4)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=== 4LiCl+S+SO2。该电池正极发生的电极反应为____________________________。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3)。
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g)△H=-90.8 kJ·mol-1
CH3OH(g)△H=-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g) △H=-41.3 kJ·mol-1
CO2(g) + H2(g) △H=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的 △H=
CH3OCH3(g) + CO2 (g)的 △H=
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
(填字母代号)。
a.压缩体积 b.加入催化剂
c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚(CH3OCH3)
(3)已知反应②:2CH3OH(g)  CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度(mol·L-1) |
0.40 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小比较:v正v逆(填“>”、“<”或“=”)。
②该反应的平衡常数的表达式为K=温度升高,该反应的平衡常数K
(填“增大”、“减小”或“不变”)
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
1根据下表中数据,在下图中画出X、Y、Z的物质的量n随时间t变化的曲线:
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| 1 |
0.90 |
0.80 |
0.20 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.55 |
0.10 |
0.90 |
| 10 |
0.55 |
0.10 |
0.90 |
| 14 |
0.55 |
0.10 |
0.90 |

2体系中发生反应的化学方程式是_____________;
3列式计算该反应在0~3 min时间内产物Z的平均反应速率:______________________;
4该反应达到平衡时反应物X的转化率α等于________;
5如果该反应是放热反应。在该反应达到上述平衡状态时改变实验条件温度、压强、催化剂得到Z的物质的量(mol)随时间t(min)变化的曲线1、2、3如上右图所示则曲线1、2、3所对应的实验条件改变分别是:1______________,2______________,3______________。
(10分)实验室利用右图所示装置进行NaHCO3的受热分解实验。请回答:
(1)加热一段时间后,烧杯中观察到的实验现象是。
(2)实验结束时的正确操作是;理由是。
(3)NaHCO3受热分解的化学方程式:。
(4)33.6gNaHCO3受热分解放出气体在标况下的体积
(11分)有一包白色固体粉末,其中可能含有KCl、BaCl2、Cu(NO3)2、K2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)写出原白色粉末中一定含有的物质的化学式
(2)写出原白色粉末中一定不含有的物质的电离方程式
(3)写出下列各步变化的离子方程式:
②
④