某实验小组同学进行如下实验,以探究化学反应中的能量变化。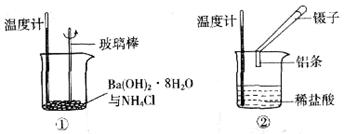
(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是____________(填“吸热”或“放热”)反应。
(2)实验②中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是____________(填“吸热”或“放热”)反应,其能量变化可用下图中的____________(填“B”或“C”)表示。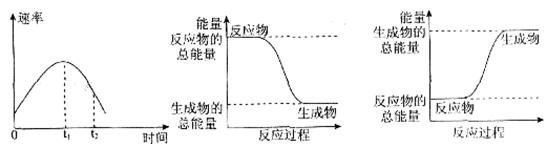
图A中0一tl段化学反应速率变化的原因是_________________________________。
(8分)请选择合适选项填空(用字母序号填空):
| A.He |
| B.Cu |
| C.H2 |
| D.NaCl |
E.KOH
F.H2O
(1)属于共价化合物的是________;
(2)含共价键的单质有________;
(3)只含有离子键的化合物有________;
(4)既有离子键又有共价键的化合物_________。
下表是元素周期表的一部分:
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是,非金属性最强的元素是。
(2)化学性质最不活泼的元素是,其原子结构示意图为。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是。
(5)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是。
Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和粘合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X 的质谱图为: |
(1)有机物X的相对分子质量是__________________。 |
| (2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 |
(2)有机物X的分子式是 __________________。 |
| (3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3︰1。 |
(3)有机物X的结构简式是 __________________。 |
Ⅱ.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是: ,
, 是由A(C5H6)和B经Diels-Alder反应制得。
是由A(C5H6)和B经Diels-Alder反应制得。
(1)Diels-Alder反应属于反应(填反应类型):A的结构简式为。
(2)写出与 互为同分异构体,且一溴代物只有两种的芳香烃的名称:;写出生成这两种一溴代物所需要的反应试剂和反应条件:。
互为同分异构体,且一溴代物只有两种的芳香烃的名称:;写出生成这两种一溴代物所需要的反应试剂和反应条件:。
X、Y、Z、R、T是原子序数依次增大的短周期主族元素,X、R在周期表中的相对位置如下表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数;Z是地壳中含量最多的金属元素。
(1)X的最高价氧化物的电子式是_________,元素T在周期表中的位置是________________。
(2)Z和T形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为________________。
(3)Y的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________。
(4)已知由X和R形成的液态化合物XR2的燃烧热是1075 kj/mol,试写出表示其燃烧热的热化学方程式________________
工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下: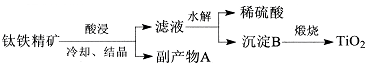
(1)写出硫酸酸浸溶解钛铁精矿的离子方程式。酸浸时为了提高浸出率,可以采取的措施为。
(2)钛铁精矿后冷却、结晶得到的副产物A为,结晶析出A时,为保持较高的酸度不能加水,其原因可能为。
(3)工业上将TiO2和碳粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式:。