冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如下图:
(1)一个水分子含_____个孤电子对,水分子能与很多金属离子形成配合物,请写出它与铜离子形成的一种蓝色的配合物离子的化学式为__________。
(2)每个冰晶胞平均占有____个水分子,冰的熔点远低于金刚石熔点的原因是__________________。
(3)实验测得冰中氢键的作用力为18.5 kJ/mol,而冰的熔化热为5.0 kJ/mol,这说明冰熔化成水,氢键_________(填全部或部分)被破坏。
(4)假如冰晶胞边长为a cm,则冰的密度是________________g·cm-3
(阿伏伽德罗常数用NA表示)。
石油化工的重要原料CxHy可以合成很多有机化合物,以下是CxHy合成物质E和J的流程图: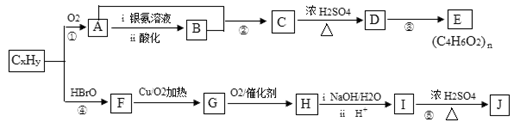
已知:Ⅰ.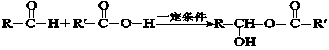 (反应中R、R′代表烃基)
(反应中R、R′代表烃基)
Ⅱ.J的分子式为C4H4O4 ,是一种环状化合物。
(1)在CxHy的同系物中,所有碳原子一定共平面且碳原子数最多的分子的名称是______。
(2)H的分子式是,CxHy的电子式为
(3)下列说法正确的是。
| A.CxHy和苯都能使溴水褪色,原理相同 |
| B.反应②和反应④的反应类型均为加成反应 |
| C.C能与Na、NaOH、NaHCO3反应 |
| D.E是一种水溶性很好的高分子化合物 |
E.J在酸性或碱性环境中均能水解
(4)K是J的同分异构体,且1 mol K与足量的NaHCO3溶液反应可放出2mol CO2气体,请写出一种符合条件K的结构简式__。
(5)写出反应⑤的化学方程式______。
(6)D有多种同分异构体,与D具有相同官能团的还有种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是。
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g)+CO2(g) + 2H2O(g)ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g)ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2=;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g)⊿H>0
2Fe(s) + 3CO(g) +6H2(g)⊿H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KAKB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些。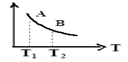
A.H2的逆反应速率
B.CH4的的体积分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为。
2NH3,该过程中还原反应的方程式为。
(4)若往20mL 0.0lmol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是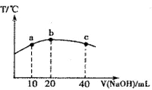
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO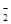 )>c(OH
)>c(OH )> c(H+)
)> c(H+)
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体。
(1)从以上元素中选择,在自然界中有游离态存在的有元素(填元素符号)。
(2)离子交换膜是一类具有离子交换功能的高分子材料。一容器被离子交换膜分成左右两部分,如图所示。
若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后可观察到的现象:右边(从下列选项中选择)
| A.无明显现象 | B.溶液由浅绿色变红色 |
| C.溶液由无色变黄色 | D.溶液由浅绿色变无色 |
左边发生反应的离子方程式:;
若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42-通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为。
(3)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用。通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b。(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃。)
①若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为。
②若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有____________;
然后向滤液中继续加适量乙酸乙酯并加热可得沉淀,写出生成沉淀的离子方程式_____。
(14分)某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32ˉ、SO42ˉ、SiO32ˉ、NO中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 ;
(2)溶液X中,关于NO3-的判断一定正确的是;
A一定有B.一定没有C.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液 ⑥氯水和KSCN的混合溶液中的一种,根据现象即可判断,该试剂最好是。
甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度(℃) |
|
| 500 |
800 |
||
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+ CO2(g)  CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。
(3)判断反应③△H0; △S0(填“>”“=”或“<”)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)v(逆)(填“>”“=”或“<”)
(4)甲醇燃料电池通常采用铂电极,其工作原理如图所示,负极的电极反应为:。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的醋酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为 。