碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。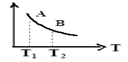
A.H2的逆反应速率
B.CH4的的体积分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
(4)若往20mL 0.0lmol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是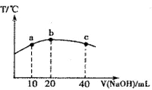
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO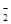 )>c(OH
)>c(OH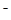 )> c(H+)
)> c(H+)
A、B、C、D、E、F六种短周期元素,原子序数依次增大。A、E同主族,元素原子的核外电子数是A元素原子核内质子数的两倍。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。D元素原子最外层电子数是次外层电子数的一半。
回答下列问题:
⑴用电子式表示B、F两元素形成化合物的过程:;
⑵A、C两元素的化合物与B的氢氧化物反应的离子方程式为 ;
;
⑶D气态氢化物的稳定性(填“大于”、“小于”)E的气态氢化物的稳定性。
主族元素A、 B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
⑴写出元素符号A____,B____,C__ __,D_ ___。
⑵写出B与C在高温下完全反应后生成物的化学式______ __,电子式___ __,结构式___ ___。
⑶用电子式表示B、D在高温下形成的化合物的电子式_____ _ ___,判断其中的化学键的类型___ _____。
⑷写出一种有A、B、C、D组成的化合物的化学式___ ___。
元素周期表的一部分,按要求完成各小题。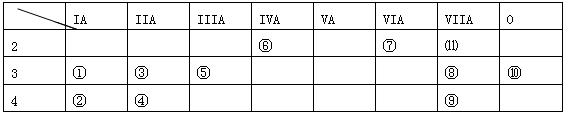
(1)、化学性质最不活泼的元素,(填元编号,下同),非金属性最强的元素是。金属性最强的单质与水反应的离子方程式为
(2)、①③⑤三种元素的最高价氧化物水化物中,碱性最强的。(填化学式)
(3)、①③⑤三种元素的原子半径由大到小的顺序为
(4)、某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为。在两种盐中该元素的化合价为,该元素的最高价氧化物和盐酸反应的化学方程式为,向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为
(1)写出表示含有8个质子、10个中子的原子的化学符号:;周期表中位于第8纵行的铁元 素属于第族;周期表中最活泼的非金属元素位于第纵行;所含元素超过18种的周期是第、周期。
素属于第族;周期表中最活泼的非金属元素位于第纵行;所含元素超过18种的周期是第、周期。
(2)按已知的原子结构规律,116号元素应是第________周期第_________族元素,它的单质在常温常压下最可能呈现的状态是__________
(8分)完成下列方程式的书写(若有几种有机产物只写主要产物):
(1)丙烯与HBr反应:
____________________________________________________。
(2)1,3—丁二烯常温下与Br2等物质的量反应:
_____________________________________________________。
(3)2—溴丁烷发生消去反应:
_____________________________________________________。
(4)甲苯与Cl2光照条件下等物质的量反应:
___________________________________________________。