亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1) 160 g/L NaOH溶液的物质的量浓度为 。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2
外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6) 从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是______。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”理由是________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_______________________。
如图为实验室分离水和乙醇的装置图,根据图示回答下列问题。
(1)图中的两处明显的错误是:______________________________,______________________________。
(2)A仪器的名称是____________,B仪器的名称是_______________。
(3)实验时向A中加入少量碎瓷片的作用是:________________________________。
(4)实验后锥形瓶中所收集到的主要物质为____________。
(8分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。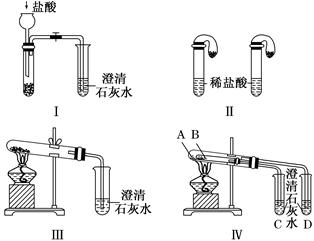
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式:__________________;
与实验Ⅲ相比,实验Ⅳ的优点是__________(填选项序号)。
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式)。
.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理: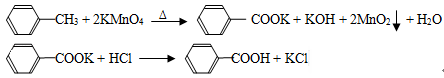
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为,操作Ⅱ为。
(2)无色液体A是,定性检验A的试剂是,现象是。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 |
实验方案 |
实验现象 |
结论 |
| ① |
将白色固体B加入水中,加热溶 解, |
得到白色晶体和无色溶液 |
----------------- |
| ② |
取少量滤液于试管中, |
生成白色沉淀 |
滤液含Cl— |
| ③ |
干燥白色晶体, |
熔点为122.4℃ |
白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数为(保留二位有效数字)。
已知离子反应:Fe3++3SCN- Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应得到的氧化产物是____________(填化学式)。
(4)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意___________________________________________________.