Ⅰ、向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol·L -1HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。(已知:Cu2O+2H+=Cu+Cu2++H2O)
(1)Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
Ⅱ、一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。当反应达到平衡时,容器内压强变为起始时的0.7倍。
2SO3(g)。当反应达到平衡时,容器内压强变为起始时的0.7倍。
请回答下列问题:
(4)判断该反应达到化学平衡状态的标志是 (填字母)。
| A.SO2、O2、SO3三者的浓度之比为2∶1∶2 | B.容器内气体的压强不变 |
| C.容器内混合气体的密度保持不变 | D.SO3的物质的量不再变化 |
E.SO2的生成速率和SO3的生成速率相等
(5) SO2的转化率 。
(17分)电化学原理在金属腐蚀、能量转换、物质合成等方面应用广泛。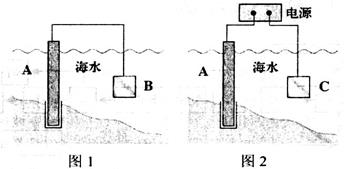
(1)通常可用图l、图2所示的两种方式减缓海水埘钢闸门A的腐蚀,则图l中材料B通常选择_________(填字母序号),图2 中材料C最好选择_________(填字母序号)。
a.钠块 b.铜块 c.锌块 d.石墨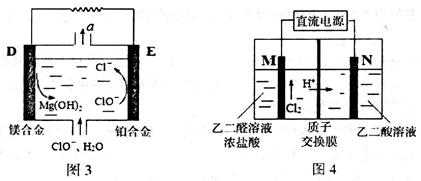
则图2中C上发生的主要电极反应式为___________________。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①D为该燃料电池的________极(填“正”或“负”)。E电极上的电极反应式为_______。
②镁燃料电池负极容易发生自腐蚀使负极利用率降低,该过程中产生的气体a为_______(填化学式)。
(3)乙醇酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸。
①乙二醛(OHC—CHO)与M电极的气体产物反应生成乙醛酸,则反应的化学方程式为____________。
②该电解装置工作中若有0.5molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为____________mol。
(16分)能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2(g)和3molH2(g) |
1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出29.4kJ |
吸收akJ |
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
①cl__________c2(填“>”、“<”或“=”),a=____________;
②该温度下反应的平衡常数K=__________;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=__________。
③下列情况能说明该反应一定达到平衡状态的是________(填字母编号);
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
④其他条件不变,达到平衡后,下列不能提高H2转化率的操作是________(填字母编号)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
(2)工业生产中H2S尾气可用NaOH溶液吸收。常温下,用a mol·L-1的NaOH溶液吸收尾气后得到的溶液中c(S2-)=c(OH-),此时溶液的pH=12,则此时溶液中的溶质为_________(填化学式),溶液中c(HS-)=__________mol·L-1(用含a的代数式表示,溶液体积变化忽略不计)。
【化学——选修3物质结构与性质】选考下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
(1)b、h两元素可形成化合物bh2,写出其电子式:。
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为,eg3、e2g6中心原子e的杂化方式分别为、。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式:。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 |
f—f |
g—g |
h—h |
i—i |
| 键能(kJ/mol) |
157 |
242.7 |
193.7 |
152.7 |
试从原子半径角度阐述f—f键键能反常的原因:。
(5)c元素的元素符号是,价电子排布式为,下图是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为:。
【化学——选修2化学与技术】选考高炉炼铁是钢铁生产中的重要环节。这种方法是由古代竖炉炼铁发展、改进而成的。尽管世界各国研究发展了很多新的炼铁法,但由于高炉炼铁技术经济指标良好,工艺简单,生产量大,劳动生产率高,能耗低,这种方法生产的铁仍占世界铁总产量的95%以上。
(1)高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是,目的是除去铁矿石中的脉石,其产物密度比铁,所以在铁水的(填“上部”或“下部”)形成炉渣而与铁水分离。
(2)焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是。
| A.作为燃料,为炼铁中的化学反应提供能量 |
| B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳 |
| C.对高炉中的物料起到支撑和疏散的作用 |
| D.除去铁矿石中的杂质 |
(3)高炉炼铁的污染非常严重,目前我国部分大城市中的钢铁厂借着搬迁的机会也在进行着工艺改进。高炉炼铁导致的环境污染有。
(4)写出以赤铁矿为原料进行高炉炼铁时与碳元素有关的氧化还原反应化学方程式:。
氯化硫酰(SO2Cl2)是一种无色液体,遇水剧烈水解,其熔点为-54.1 ℃,沸点为69.1 ℃,可用作氯化剂及锂电池正极活性物质。氯化硫酰可用下列反应制取:
SO2(g)+Cl2(g) SO2Cl2(l)△H=-97.3 kJ/mol。
SO2Cl2(l)△H=-97.3 kJ/mol。
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是(用字母编号填写):。
a.缩小容器体积 b.使用催化剂c.提高SO2浓度 d.提高温度
(2)300 ℃时,在体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300 ℃时合成SO2Cl2反应的平衡常数的为:。
(3)某同学设计了下图所示装置制取氯化硫酰:
①有关该装置的说法正确的是(用字母编号填写):。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭起催化作用
c.B处反应管的冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
②从化学平衡的角度分析,反应管通冷却水的目的是:。
③氯磺酸(ClSO3H)受热分解也可制得氯化硫酰,并得到另外一种物质,该反应的化学方程式为______,分离产物的方法是:。
(4)下图为GET公司开发的Li-SO2Cl2军用电池的示意图。已知该电池的总反应为:2Li+SO2Cl2=2LiCl+SO2↑,则该电池工作时的正极反应为:_______________________。