由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,
产生的尾气经处理后可用于钢材镀铝。工艺流程如下:
  |
 |
(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(1) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为:
① ________________________________________________________________________
② ________________________________________________________________________。
(2) 将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有_________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在__________。
(3) 在用废碱液处理气体A的过程中,所发生反应的离子方程式为:_____________________________
__________________________________________________________________。
(4) 镀铝电解池中,金属铝为________极。熔融盐电镀液中铝元素和氯元素主要以AlCl 和Al2Cl
和Al2Cl 形式存在,铝电极的主要电极反应式为_____________________________________。
形式存在,铝电极的主要电极反应式为_____________________________________。
(5) 钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是_________________。
(8分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式如下:
这种材料可采用如下图所示的合成路线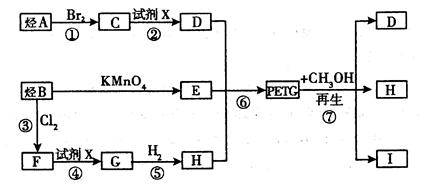
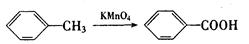
(1) 
(2)RCOORl+R2OH→RCOOR2+R1OH(R、R1、R2表示烃基)
试回答下列问题:
(1)⑦的反应类型是 。
(2)写出I的结构简式: 。
(3)合成时应控制的单体的物质的量:n(H):n(E):n (D)=(用m、n表示)。
(4)写出反应②的化学方程式:
(5)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①该同分异构体的苯环上相邻的三个碳原子上都连有取代基。
②该同分异构体在一定条件下能发生银镜反应和水解反应,遇到FeCl3溶液显紫色。
、 、 。
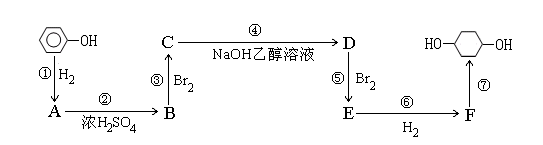
以苯酚为原料的合成路线如下所示,请按要求作答:
(1)写出以下物质的结构简式:BF
(2)写出反应①④的化学反应方程式:
①
④
(3)反应⑤可以得到E,同时可能得到的副产物的结构简式为:
书写下列反应的化学方程式:
(1)、丙烯加聚
(2)、乙醛的银镜反应
(3)、2-丙醇的催化氧化
(4)、由甲苯制TNT炸药
(5)、实验室制取乙炔
室安卡因(G)是一种抗心率天常药物,可由下列路线合成;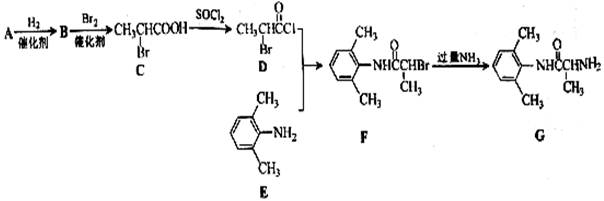
(1)已知A是 的单体,则A中含有的官能团是(写名称)。B的结构简式是。
的单体,则A中含有的官能团是(写名称)。B的结构简式是。
(2)C的名称(系统命名)是,C与足量NaOH醇溶液共热时反应的化学方程式是。
(3)X是E的同分异构体,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有 、、、。
、、、。
(4)F→G的反应类型是。
(5)下列关于室安卡因(G)的说法正确的是。
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d..属于氨基酸
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
请回答下列问题:
(1) A的化学名称是_______;
(2) B和A反应生成C的化学方程式为___________,该反应的类型为_____________;
(3) D的结构简式为___________;
(4) F的结构简式为_____________;
(5) D的同分异构体的结构简式为___________。