已知H2A在水中存在以下平衡:H2A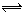 H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定” ,下同),某二元酸H2B电离方程式是:H2B H++HB-,HB- B2-+H+,NaHB溶液________。
B2-+H+,NaHB溶液________。
(2)某温度下,向0.1 mol/L的NaHA溶液中滴入0.1 mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol2/L2 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)  Ca2+(aq)+A2-(aq) ΔH>0。
Ca2+(aq)+A2-(aq) ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是
__________________________________________(用文字和离子方程式说明)。
1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 |
Cl- Br- I- ClO- AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如下图所示。
则该溶液中确定含有的离子有;
不能确定是否含有的阳离子有,
要确定其存在可补充做的实验是;
肯定不存在的阴离子有。
(2)若经检测,该溶液中含有大量的Cl—、Br—、I—,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl—、Br—、I—的物质的量与通入Cl2的体积(标准状况下)的关系如下图所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
| n (Cl-) |
1.25mol |
1.5mol |
2mol |
| n (Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
amol |
0 |
0 |
①当通入的Cl2的体积为2.8L时,溶液中发生反应的离子方程式为:;
②原溶液中Cl—、Br—、I—的物质的量浓度之比为;
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复):H+、Na+、A13+、Ag+、Ba2+、 OH—、C1—、CO32—、NO3—、SO42—已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。③D溶液与另外四种溶液反应都能产生沉淀。④在E溶液中逐滴加入B溶液,溶液先出现沉淀,当滴加至过量时,沉淀部分溶解。试回答下列问题:
(1)A、C的化学式分别为、。
(2)A溶液呈碱性的原因(用离子方程式表示)。
(3)在100mL0.1mol·L-1的E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀的物质的量为
mol。
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为__________(填化学式)。
(2)要得到稳定的HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是_________(填序号)。
| A.稀硫酸 | B.二氧化碳 | C.二氧化硫 | D.磷酸 |
(3)工业废水中的NO2-可用铝粉除去.已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质.将氧化剂和还原剂的化学式及其配平后的系数填入下列横线上:_______+ _______
上述反应后废水的pH值将________(填“增大”、“减小”或“不变”)。
(4)向20mL 0.01mol·L-1的NaNO2溶液中加入10mL 0.01 mol·L-1的AgNO3溶液,一段时间后,溶液中的c(Ag+)=________________________________。(已知:KSP(AgNO2)=2×10-8 mol2·L-2)
有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4,且A不能使Br2的CCl4溶液褪色;1mol B反应生成了2mol C。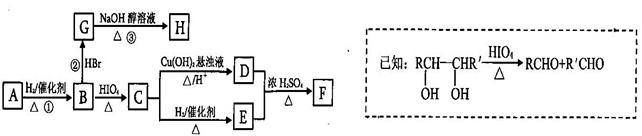
请回答下列问题:
(1)C→E的反应类型为_______________________ 。
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.09%,则由A合成H的总产率为___________________ 。
(3)A的结构简式为__________________________ 。
(4)写出C与银氨溶液反应的离子方程式为________________________________ 。
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为: ___________________。
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________________________。
某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐。在反应后的溶液中,逐滴加入4mol·L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示。分析图像回答问题: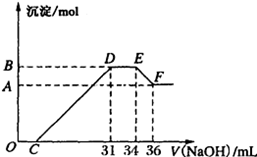
(1)DE段发生反应的离子方程式为:_____________________________________ 。
(2)请写出任意一个Al、Fe与极稀HNO3反应的化学方程式:_______________ 。
(3)B点对应的沉淀的物质的量为_______mol,C点对应的氢氧化钠溶液的体积为______mL。
(4)原硝酸溶液的物质的量浓度为_______mol/L。