磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g) ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g) ΔH1="+3" 359.26 kJ·mol-1
CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g) ΔH3
6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3= kJ·mol-1。
(2)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1="-197" kJ·mol-1;
2SO3(g) ΔH1="-197" kJ·mol-1;
H2O(g) H2O(l) ΔH2="-44" kJ·mol-1;
H2O(l) ΔH2="-44" kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g) 2H2SO4(l) ΔH3="-545" kJ·mol-1。
2H2SO4(l) ΔH3="-545" kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是 。
(3)大气中的部分碘源于O3对海水中I-的氧化。O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g) IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HIO(aq) ΔH2
HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为 ,其反应热ΔH= 。
工业上用CO生产燃料甲醇。一定条件下发生反应: 。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
请回答下列问题:
(1)在“图1”中,曲线(填a或b)表示使用了催化剂;该反应属于(填吸热、放热)反应。
(2)下列说法正确的是
| A.起始充入的CO为1mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
(3)从反应开始到建立平衡,v(H2)=;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ;ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式。
已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______。
| A.一定向正反应方向移动 | B.一定向逆反应方向移动 |
| C.一定不移动 | D.不一定移动 |
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2 mol B,则
反应达到平衡时,C的体积分数为_______;容器的容积为_______。
0.1mol/L的HCN溶液与0.1mol/L的NaCN溶液等体积混合,混合后溶液的pH>7,说明:HCN的电离程度CN-的水解程度;离子浓度大小顺序为电荷守恒__________;物料守恒_____
已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
请回答:
(1)A中的现象,B中的现象 ;
(2)由此可知,降低温度,该化学平衡向(填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为,升高温度,该反应中NO2的转化率将 (填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后颜色变深的原因是;
②一段时间后气体颜色又变浅的原因是;
③由此实验得出的结论是 。
(2)将第三支针筒活塞快速拉至20cm3处,该同学观察到的现象是 ;
在此过程中,该反应的化学平衡常数将(填“增大”、“减小”或“不变”,下同),NO2的转化率将。
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ;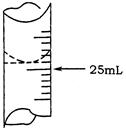
(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.11 |
| 2 |
25.00 |
1.56 |
31.30 |
| 3 |
25.00 |
0.22 |
26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (小数点后保留四位);
(3)下列哪些操作会使测定结果偏高(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
__________________________________________________。