下列关于酸性氧化物、碱性氧化物、单质、混合物的分类中,正确的是 ( )
| |
酸性氧化物 |
碱性氧化物 |
单质 |
混合物 |
| A |
干冰 |
Na2O |
金刚石 |
浓盐酸 |
| B |
CO |
Fe3O4 |
溴 |
漂白粉 |
| C |
SO2 |
Na2O2 |
石墨 |
福尔马林 |
| D |
SO3 |
Fe2O3 |
硫黄 |
FeSO4·7H2O |
向0.1 mol·L-1 NaOH溶液中通入过量CO2后,溶液中存在的主要离子是()
A.Na+、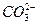 |
B.Na+、 |
C. 、 、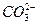 |
D.Na+、OH- |
钡的活动性处于钾和钠之间,下列反应可以实现的是( )
| A.钡可以从熔融的氯化钾中置换出钾 |
| B.钡可以从氯化钠溶液中置换出钠 |
| C.钡可以从冷水中置换出氢而得到氢气 |
| D.在溶液中钡离子可以氧化金属锌 |
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。下列分析推理不正确的是()
| 50 mL盐酸 |
50 mL盐酸 |
50 mL盐酸 |
|||||
| m(混合物) |
9.2 g |
15.7 g |
27.6 g |
||||
| V(CO2)(标准状况) |
2.24 L |
3.36 L |
3.36 L
|
以下关于锂、钠、钾、铷、铯的叙述不正确的是……()
①氢氧化物中碱性最强的是CsOH
②单质熔点最高的是铯
③它们都是热和电的良导体
④它们的密度依次增大,且都比水轻
⑤它们的还原性依次增强
⑥它们对应离子的氧化性也依次增强
| A.①③ | B.②⑤ | C.②④⑥ | D.①③⑤ |
焰火“脚印”“笑脸”“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是( )
| A.非金属单质燃烧时火焰均为无色 |
| B.所有金属及其化合物灼烧时火焰均有颜色 |
| C.焰色反应均应透过蓝色钴玻璃观察 |
| D.NaCl与Na2CO3灼烧时火焰颜色相同 |