金属镁的制取主要有两种途径,大约60%的镁是从海水中提取的,其余来自于含镁丰富的矿石,比如菱镁矿(主要成分为MgCO3)。从不同途径获得镁的流程如下: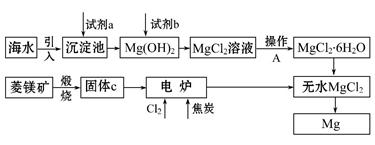
回答下列问题:
(1)试剂a的化学式是 。
(2)加入试剂b发生反应的离子方程式是
。
(3)操作A是蒸发浓缩、冷却结晶、 。
(4)在电炉中参加反应的n(Cl2)∶n(焦炭)=1∶1,则该反应的化学方程式是
。
(5)上述制镁的流程中,为降低成本、减少污染可采取的措施是(写出一种即可)
。
(1)亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、
Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有________,看到的现象是 ________,反应的方程式为___________________________
(2)实验室制取氯气的化学方程式:括号中为杂质,填上除杂试剂:Cl2中(HCl) 。
(3)由SiO2制取粗硅的化学方程式
(4)将ag由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为ag (> ;< ;=)
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。
漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为;漂白粉的有效成分是(填化学式)。该反应中氧化剂与还原剂物质的量之比是。
I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为。
SO2按还原性由强到弱顺序排列为。
II (4) 除去铁粉中混有铝粉的试剂是,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物: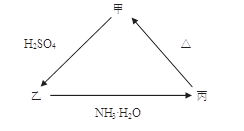
(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液, 写出下列转化的方程式:
乙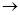 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙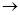 甲的化学方程式____________________。
甲的化学方程式____________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。 甲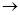 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。
今有A.醋酸,B.盐酸, C.硫酸三种酸,请用三种酸的序号和“>”、“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是。
(2)在同体积、同物质的量浓度的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是。
(3)物质的量浓度均为0.1mol/L的三种酸溶液的pH由大到小的顺序是;如果取等体积的0.1mol/L的三种酸溶液,用0.1mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是。