为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A接 , 接 , 接B(本小题2分);
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2 ? ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。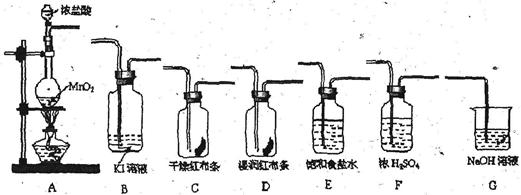
(1)上述装置中各仪器从左至右的连接顺序为A接__接__接__接__接__接G。
(2)E装置的作用是__________,D中的现象为____,B中的现象为_________。
(3)写出相关反应的离子方程式:A中___________,G中______________。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。
(19分)实验室欲用胆矾配制250 mL0.2 mol·L-1的CuSO4溶液。
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A 计算B 称量 C.溶解D.______E. ______F. 定容 G. 摇匀、装瓶
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、量筒还有______
和______(填仪器名称)
(3)经计算需要称取CuSO4·5H2O的质量为______。
(4)若称取胆矾时砝码被放在左盘(10g以下用游码),则配制的CuSO4溶液的浓度______(填“偏高”、“偏低”、“无影响”);若定容时仰视刻度线,则配制的CuSO4溶液的浓度______ (填“偏高”、“偏低”、“无影响”)。
(5)从准确配制好的CuSO4溶液中取出50mL ,则这50mL CuSO4溶液的物质的量浓度为______________,所含Cu2+的质量为。
下图所示是分离混合物时常用的仪器,回答下列问题: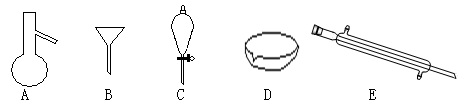
(1)写出仪器C、E的名称、
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙:②花生油和水:
(3)若向C装置中加入碘水和足量CCl4,充分振荡后静置,观察到现象是:C内液体分两层,上层液体呈色,下层液体色。
(4)碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:
A.汽油 B.CCl4C.酒精 D.醋酸
已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式:。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。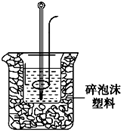
①实验时所需的玻璃仪器除烧杯、量筒外还需:。
②该装置中有一处错误是:,如果用该错误装置测定,结果会(填“偏
高”“偏低”“无影响”)
③如果,该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理
由是:。在该实验中需要测定某种数据,
完成一次实验,需要测定该数据的次数为次。
(3)学生乙用2 mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图(Ⅰ)装置:

图Ⅰ图Ⅱ
①该生两次实验测定时间均设定为10 min,那么他还要测定的另一个数据是:
。
②如果将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所处的刻度数,发现滴定管中液面高于干燥管中液面,应先采取的操作是:。③该实验结果中,你估计与酸反应较快的是。
(1)现需配制0.1mol/LNaOH溶液480mL,右图是某同学转移溶液的示意图。
①图中的错误是。
除了图中给出的的仪器和托盘天平外,
为完成实验还需要的仪器有:。
②根据计算得知,所需NaOH的质量为g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(2)固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg、NO2、O2乙:MgO、NO2、O2丙:MgO、NO2、N2丁:Mg3N2、O2
A.实验前,小组成员经讨论认定猜想丙不成立,理由是。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丁猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):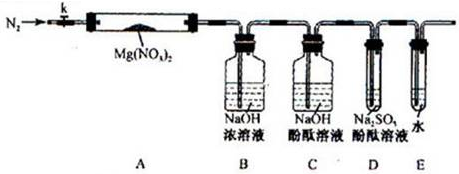
B.实验过程
① 取器连接后,放人固体试剂之前,应进行的操作是
② 称取Mg(NO3)2固体3.79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③ 观察到A中有红棕色气体出现,C、D中未见明显变化。
④ 待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0g
⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
C.实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_________________________________。