(有机化学基础)蜂胶是一种天然抗癌药
物,一个五六万只的蜂群一年只能产100多克蜂胶,所
以蜂胶又被誉为“紫色黄金”。蜂胶的主要活性成分为
咖啡酸苯乙酯,其分子结构如下图所示(短线表示化学
键,如单键、双键等),在一定条件下能发生如下转化: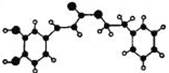

请回答下列问题:
(1)咖啡酸苯乙酯的分子式为 ,C结构简式为 。
(2)① A中含氧官能团的名称为 、 。
② A 可以发生的反应是 (填字母)
a 加成反应 b 酯化反应 c 消去反应 d 氧化反应
③ A 与甲醇反应生成B的化学方程式是 。
(3)高分子E的结构简式是 。
(4) 发生反应的反应类型是 。
发生反应的反应类型是 。
(5)B的同分异构体有很多种,其中同时符合下列条件的同分异构体的结构简式为 。
a 苯环上只有两个取代基 b 能发生银镜反应 c 能与氢氧化钠溶液反应
d 不能与氯化铁溶液发生显色反应 e 核磁共振氢谱图中有三组峰
已知A是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
请回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)物质B可以被直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式及其反应类型。
① ;反应类型: 。
④ ;反应类型: 。
(1)苯、四氯化碳、乙醇都是常见的有机溶剂。能与水互溶的是 ;难溶于水,且密度比水小的是 。
(2)一瓶无色气体,可能含有CH4和CH2 CH2,也可能是其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有无色油状小液滴。
CH2,也可能是其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有无色油状小液滴。
①由上述实验现象推断出该混合气体中一定含有CH4,你认为是否正确,说明理由。
____________________________________
②上述实验过程中可能涉及的反应类型有:_____________
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合。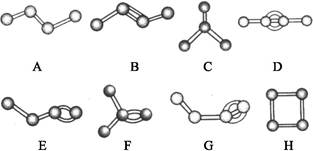
(1)图中属于烷烃的是 。(填编号)
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成碳碳单键,还可以形成 和 ;不仅可以形成 ,还可以形成碳环。
(3)上图中互为同分异构体的是:A与 ;B与 ;D与 。(填编号)
已知化学能与其他形式的能可以相互转化。填写下表的空白:
| 化学反应方程式(例子) |
能量转化形式 |
| ① |
由化学能转化为热能 |
②Pb+PbO2+2H2SO4 2PbSO4+2H2O 2PbSO4+2H2O |
|
③CaCO3 CaO+CO2↑ CaO+CO2↑ |
上述反应中属于氧化还原反应的是(填序号) 。
选择适宜的材料和试剂设计一个原电池,完成下列反应:
Zn+CuSO4=ZnSO4+Cu
(1)画出装置图,并标明各部分材料名称。
(2)负极材料 ,正极材料 ,电解质溶液是 。
(3)写出电极反应式:
负极: _______________________
正极: _______________________