下列关于C、Si、Ge、Sn、Pb的比较,正确的是( )
A.它们的最外层电子数随核电荷数增加而增多
B.它们的最高价氧化物均可溶于水生成相应的酸
C.它们单质的氧化性随核电荷数的增加而逐渐减弱
D.它们的氢化物的稳定性随核电荷数的增加而逐渐增强
某溶液中只可能含有下列离子中的几种:K+、NH4+、NO3-、SO42-、SO32-、CO32-, 取200mL该溶液分成两等份,进行以下实验:
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。
(2)第二份先加足量的盐酸无现象,再加足 量的BaCl2,得到2.33g固体,则该溶液中()
量的BaCl2,得到2.33g固体,则该溶液中()
| A.可能含有K+、CO32- | B.一定含有K+且c(K+)≥0.1mol/L |
| C.一定不含有NO3- | D.肯定含有NO3-、SO42-、NH4+ |
设NA表示阿伏加德罗常数,下列叙述中正确的是()
| A.1.8gNH4+中含有的电子数为NA |
| B.常温常压下4.6gNO2气体中含有的分子数为0.1NA |
| C.100mL0.1mol·L-1Na2CO3溶液中含有的CO32-数目为0.01NA |
D.15.6gNa2O2与过量的CO2反 应时,转移的电子数为0.4NA 应时,转移的电子数为0.4NA |
实验室从海带灰中提取碘的操作过程,仪器选用不正确的是()
| A.称取3g左右的干海带:托盘天平 |
| B.灼烧干海带至完全变成灰烬:蒸发皿 |
| C.过滤煮沸后的海带灰水混合液:漏斗 |
| D.用四氯化碳从氧化后的海带灰水溶液中提取碘:分液漏斗 |
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL,反应后溶液中 的物质的量浓度为(忽略溶液体积的变化) ( )
的物质的量浓度为(忽略溶液体积的变化) ( )
| A.0.4 mol/L | B.0.3 mol/L | C.0.2 mol/L | D.0.1 mol/L |
有一真空瓶的质量为W1 g,向该瓶充入氧气后的质量为W2 g,在相同条件下充入某一单质气体,其质量为W3 g,则此单质气体的摩尔质量为 ( )
A.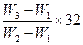 |
B.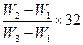 |
C.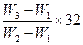 g/mol g/mol |
D.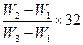 g/mol g/mol |