“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1 100 ℃时测得高炉中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向 进行(填“左”或“右”),判断依据是 。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0KJ/mol,现向体积为1L的密闭容器中充入1mol CO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0KJ/mol,现向体积为1L的密闭容器中充入1mol CO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。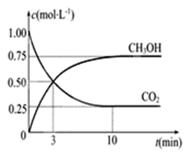
①从反应开始到平衡,氢气的平均反应速率V(H2)=------------。
②反应达到平衡后,下列措施能使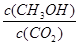 增大的是-------(填符号)
增大的是-------(填符号)
| A.升高温度 | B.再充入H2 | C.再充入CO2 | D.将H2O(g)从体系中分离E.充入He(g) |
法常用于处理含难降解有机物的工业废水,通常是在调节好
和
浓度的废水中加入
,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物
,探究有关因素对该降解反应速率的影响。 [实验设计]控制
的初始浓度相同,恒定实验温度在298
或313
(其余实验条件见下表),设计如下对比试验。
[实验设计]控制
的初始浓度相同,恒定实验温度在298
或313
(其余实验条件见下表),设计如下对比试验。 (1)请完成以下实验设计表(表中不要留空格)。
(1)请完成以下实验设计表(表中不要留空格)。
实验 编号 编号 |
实验目的 |
||||
| ① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
 |
298 |
10 |
6.0 |
0.30 |
 [数据处理]实验测得
的浓度随时间变化的关系如右上图。
[数据处理]实验测得
的浓度随时间变化的关系如右上图。

(2)请根据右上图实验①曲线,计算降解反应在50~150
内的反应速率: (
)=
(
)=
 [解释与结论]
[解释与结论] (3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从
法所用试剂
的角度分析原因:。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从
法所用试剂
的角度分析原因:。 (4)实验③得出的结论是:
等于10时,。
(4)实验③得出的结论是:
等于10时,。 [思考与交流]
[思考与交流] (5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:

 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:



(1)
与银氨溶液反应有银镜生成,则A的结构简式是。 (2)
的反应类型是。
(2)
的反应类型是。 (3)
的结构简式是。
(3)
的结构简式是。 (4)写出
和过量
溶液共热时反应的化学方程式:
(4)写出
和过量
溶液共热时反应的化学方程式:
。 (5)下列关于G的说法正确的是
(5)下列关于G的说法正确的是
 a.能与溴单质反应 b. 能与金属钠反应
a.能与溴单质反应 b. 能与金属钠反应 c. 1mol
最多能和3mol氢气反应 d. 分子式是
c. 1mol
最多能和3mol氢气反应 d. 分子式是

在50 mL 0.2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中浓度将怎样变化___________________________。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是___________________________________。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol电子通过时,阴极增重__________g,阴极上的电极反应式是__________。
在120 ℃时分别进行如下四个反应:
| A.2H2S+O2====2H2O+S | B.2H2S+3O2====2H2O+2SO2 |
| C.C2H4+3O2====2H2O+2SO2 | D.C4H8+6O2====4H2O+4CO2 |
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是_________;符合关系式d前=d后和p前=p后的是_________。(请填写反应的代号)
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系d前>d后和V前<V后的是_________;符合d前>d后和V前>V后的是_________。(请填写反应的代号)
1.88 g某相对分子质量为117.5的易燃物质NxHyClzOw可以自身发生爆炸,生成0.432 g水、358.4 mL氯化氢、448 mL O2和若干克N2(体积均为标准状况下测定)。则此易燃物质的化学式为_________,爆炸反应的化学方程式为___________________________。