【化学——选修3:物质结构与性质】
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示。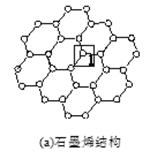
(1)基态碳原子的核外电子有_________种运动状态。
(2)图(a)中,1号C与相邻C形成σ键的个数为________。
(3)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(4)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
(5)石墨烯可转化为富勒烯分子(C60),C60属于________晶体,某金属M与C60可制备一种低温超导材料,晶胞如图所示,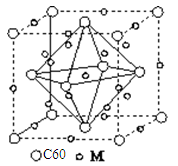
M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
2SO2(g)+ O2(g) 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答: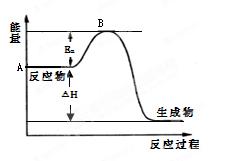
⑴图中A点表示_________ ________,a=__________。
________,a=__________。
⑵Ea的大小对该反应的△H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点___________(填“升高”、“降低”或“不变”)。
⑶已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:____,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为____。
将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。已知:
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1= 。
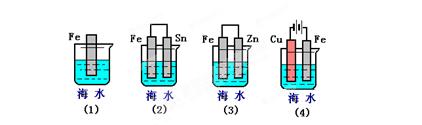
下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(8 分)一定温度下,将2mol SO2气体和1mol O2气体通过一密闭容器中,发生如下
分)一定温度下,将2mol SO2气体和1mol O2气体通过一密闭容器中,发生如下
反应:2SO2(g)+O2 (g) 2SO3(g)。请填写下列空白:
2SO3(g)。请填写下列空白:
若容器体积固定为2L,反应1min时测得剩余1.2mol SO2,SO3的浓度为0.4mol/L。
①1min内,O2的平均反应速率为;
②若反应经2min达到平衡,平衡时SO3的浓度__0.8mol/L (填“大于”、“等于”或“小于”);
(填“大于”、“等于”或“小于”);
③改变起始物质加入的量, 欲使反应达到平衡时SO3的物质的量分数与原平衡相等,起始加入的三种物质SO2、O2 、SO3的物质的量a、b、c之间应满足的关系式;。
欲使反应达到平衡时SO3的物质的量分数与原平衡相等,起始加入的三种物质SO2、O2 、SO3的物质的量a、b、c之间应满足的关系式;。
海产品中常含有较多的碘元素,因此海边的居民很少患碘缺乏病。某化学兴趣小组的同学通过以下步骤提取海带中的碘: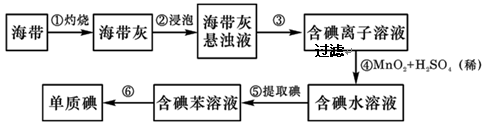
(1 )步骤③用到的玻璃仪器主要有漏斗、烧杯和。
)步骤③用到的玻璃仪器主要有漏斗、烧杯和。
(2)步骤⑤用有机溶剂苯将碘从水中提取出来的过程叫。静置分层后下层液体是。
(3)我国从1994年起推出全民食用加碘盐工程,至今,覆盖率已超过95%,补碘成效显著。我们可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾(KIO3),反应后可观察到溶液变蓝,该反应的离子方程式为_____。