实验室可用MnO2和KClO3混合加热的方法制取氧气。现有下列仪器或装置:
Ⅰ.(1)A~D装置中,用作KClO3为原料制氧气的反应装置是 (填序号);
(2)排水法收集氧气,接口顺序是:氧气出口→ → →g→h→烧杯(填序号)。
Ⅱ. KClO3分解时尚有副反应,导致收集到的气体有异味.据推测,副产物可能是O3、Cl2、ClO2中的一种或几种.资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2.为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入下图装置进行实验:
(3)若要确认副产物中含Cl2,F中应盛放 溶液。
(4)确定副产物中含有ClO2的现象是 。
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有O3的结论?理由是 。
Ⅲ.ClO2是饮用水消毒剂.用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-.为测定此饮用水中两者成分,进行如下实验:准确量取VmL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I-═I2+2ClO2-,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后叉产生b mol I2。
(6)饮用水中c(ClO2-)= mol•L-1(用含字母的代数式表示)。
为了粗略测定电石中碳化钙的质量分数,某研究性学习小组设计了如下图所示的制气与除杂装置。请参与研究并回答相关问题: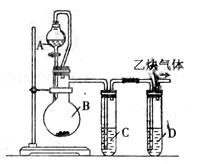
(1)写出烧瓶B中发生反应的 化学方程式:___
化学方程式:___ ___________________________。
___________________________。
(2)漏斗与烧瓶之间用玻璃导管连接,其目的是________________________________________________________。
(3)试管中装有同一种蓝色溶液,该溶液是____________,其中试管C的作用是_______________________,试管D的作用是____________ ____________。
____________。
(4) 为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______
为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______ __(填Ⅰ或Ⅱ)。
__(填Ⅰ或Ⅱ)。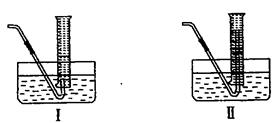
用下图所示实验装置制取乙酸乙酯。回答以下问题: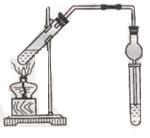
(1)在大试管中配 制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:将,
制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:将,
然后轻轻振荡试管,使之混合均匀。
(2)加入浓硫酸的目的是:。
(3)饱和碳酸钠溶液的作用是:。
(4)实验生成的乙酸乙酯,其密度比水 (填“大”或“小”),有气味。
(填“大”或“小”),有气味。
(5)若实验中反应温度不当,使反应温度维持在140℃左右,此时副反应的主要有机产物是。
(6)球形干燥管的作用有:①;②。
某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL的容量瓶中定容配成250 mL烧碱溶液 |
| B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读 数为V1 数为V1 |
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是→ → →D→(均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________。
(4)D步骤中液面应调节到________________________________________________________________________,尖嘴部分应_____________________________________________________________。
(5)滴定终点时锥形瓶内溶液的pH约为____________,终点时颜色变化是
________________________________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?(填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为_________ ______________________________________。
______________________________________。
(1)下图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是_(填代号)。
①亚硫酸钠和硫酸②二氧化锰和浓盐酸③浓氨水和生石灰④石灰石和稀硫酸⑤锌和稀硫酸⑥硫化亚铁与稀硫酸⑦双氧水和二氧化锰
(2)有两瓶失去标签的物质的量浓度相同的碳酸钠溶液和碳酸氢钠溶液,请你加以鉴别:
①下列试剂中,可选用的一种试剂是_______(填代号)。
| A.氢氧化钠溶液 | B.甲基橙溶液 | C.稀盐酸 | D.澄清石灰水 |
②除上述方法外,你认为是否还有其它的方法,具体如何操作_______。
(3)实验室需要用纯净的NaCl溶液,现有的NaCl晶体中混有少量的Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
①除去(NH4)2CO3用加热好还是加强碱后再微热好?你选择的是,其理由是
。
②以下是除去SO42-的实验方案。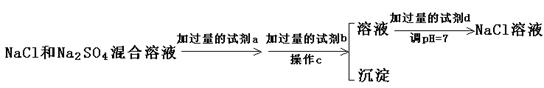
过量的a试剂是,C操作中所使用的玻璃仪器的名称是,证明SO42-已经沉淀完全的方法是 。
。
某同学取一定量淀粉进行水解实验,其实验步骤如下所示:
请回答下列问题:
①所加入的试剂分别是
A________,B________,C________;
②加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。