某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究。
【提出假设】:小组同学经过分析讨论认为生成气体可能含H2和SO2。
【设计实验方案,验证假设】主要包括两个环节:
Ⅰ.验证SO2,实验装置如图所示;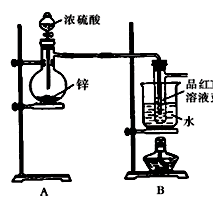
Ⅱ.检验产物中含有H2,实验内容将由B部分导出的气体依次通过装置
C、D、E、F、G。Ⅱ中装置C、D、E、F、G的信息如下表所示:
| 仪器标号 |
C |
D |
E |
F |
G |
| 仪器 |
洗气瓶 |
洗气瓶 |
硬质玻璃管,加热 |
干燥管 |
干燥管 |
| 仪器中所加物质 |
NaOH溶液 |
浓硫酸 |
CuO粉末 |
试剂X |
无水CaCl2固体 |
试回答下列问题:
(1)小组同学认为生成气体中含H2的理由是 ;
(2)盛放锌粒的仪器名称是 ;
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性,实验的操作及主要现象是 ;
(4)①装置D、G的作用依次是 、 ;
②E中发生反应的化学方程式是 ;
③试剂X是 。
完成下面问题:
(1)分离沸点不同但又互溶的液体混合物,常用什么方法?
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: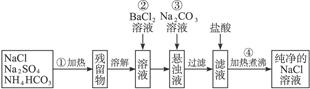
图1-7
如果此方案正确,那么:
(1)操作①可选择____________或____________仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么?
(3)进行操作②后,如何判断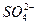 已除尽,方法是____________。
已除尽,方法是____________。
(4)操作③的目的是_________________________________________,为什么不先过滤后加碳酸钠溶液?理由是_________________________________________________。
(5)操作④的目的是
_____________________________________________________________。
实验室进行NaCl溶液蒸发时,一般有以下操作过程,其正确的操作顺序是( )
①放置酒精灯②固定铁圈的位置③放上蒸发皿④加热搅拌⑤停止加热、余热蒸干
| A.①③②④⑤ |
| B.①②③④⑤ |
| C.②③①④⑤ |
| D.②①③④⑤ |
下列实验操作错误的是( )
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液蒸干 |
| D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下研究过程。
(1)甲同学首先设计了实验室制取二氧化碳的三种发生装置,若选用碳酸氢钠分解制二氧化碳应选用装置是_______(填装置序号“A”“B”或“C”,下同);若用石灰石与稀盐酸为原料,并能控制反应随时发生随时停止,最好应选用的装置是_______;若用碳酸钠固体与稀硫酸反应应选用的装置是_______。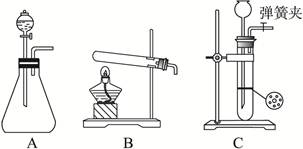
(2)乙同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题: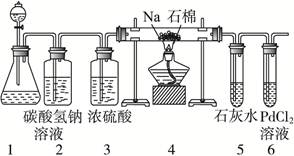
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
(3)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有Na2O和C。