完成下面问题:
(1)分离沸点不同但又互溶的液体混合物,常用什么方法?
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
用化学方法测定微量碘化物时,必须利用“化学放大”反应将碘的量“放大”,然后再进行测定。下面是“化学放大”反应的实验步骤:
①向含微量I-并且呈中性或弱酸性溶液里加入溴水,将I-完全氧化成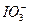 ,煮沸去掉过量的Br2;
,煮沸去掉过量的Br2;
②向由①制得的水溶液中加入过量的酸性KI溶液,振荡使反应进行完全;
③在②得到的水溶液中加入足量的CCl4,振荡,把生成的I2从水溶液里全部转移到CCl4中,用分液漏斗分液去掉水层;
④向③得到的CCl4层加入肼(即联氨H2N—NH2)的水溶液,振荡,使I2完全以I-形式从CCl4层进入水层,用分液漏斗分液去掉CCl4层。
经过以上四步得到的水溶液里,含有通过反应而“放大”了的碘,请回答下列问题:
(1)写出步骤②的离子方程式,并标出下列反应的电子转移的方向和数目:_______________________。
(2)将右图所示的分液漏斗中的下层液体放出的操作步骤为:
①___________________________________________。
②旋开活塞,使下层液体流出到一个烧杯里,当下层液体全部流出活塞的细孔时,__________________。
③从漏斗上口倒出上层液体。
④旋开活塞,将留在颈部的下层液体放出到盛接下层液体的烧杯里。
(3)若忽略实验过程中出现的损失,经过一次“化学放大”的溶液里,I-的量是原溶液里I-的量的____________倍。经过n次“化学放大”的溶液里,I-的量是原溶液里的量的________倍。
实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100 ℃左右时升华。如下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。完成下列问题: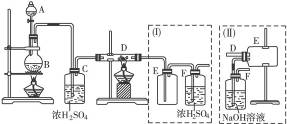
(1)B中反应的化学方程式为:__________________________________。
(2)D中反应开始前,需排除装置中的空气,应采取的方法是:__________________________。
(3)D中反应的化学方程式为:__________________________________。
(4)装置(Ⅰ)的主要缺点是:_____________________________________。
(5)装置(Ⅱ)的主要缺点是:_____________________________,如果选用此装置来完成实验,则必须采取的改变措施是:_____________________________________________。
根据下图所示实验,填空和回答问题。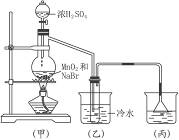
(1)烧瓶中所发生的主要反应的化学方程式是___________;装置(乙)的烧杯中冷水所起的作用是___________;装置(丙)的烧杯中液体的作用是___________。
(2)进行此实验时,烧杯内的橡皮塞最好用铝箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为___________,装置(丙)的烧杯中使用倒置漏斗可防止液体倒吸,其原因是___________。
某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图4-3所示。
图4-3
(1)写出该反应的化学方程式: 。
(2)上述反应中,还原剂是 ,若有1 mol氧化剂参加反应,转移的电子的物质的量是 mol。
(3)实验开始前,某学生对装置进行了气密性检查。方法:连接好装置后,用弹簧夹夹
住 (填“A”或“B”)处橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中 时,表明该装置不漏气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是(填序号) 。
A.氢氧化钠溶液
B.碳酸钠浓溶液
C.浓硫酸
用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去。试完成下列问题:
(1)产生上述现象的原因可能有两种,请用简要的文字说明:
①____________________________________________。
②____________________________________________。
(2)简述怎样用实验证明红色褪去的原因是①还是②:______________________________。