某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
【提出问题】①氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计并完成实验】
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将x g氯酸钾与1.0g氯化铜均匀混合加热
【实验现象分析】
Ⅲ中x的值应为 ,将实验Ⅰ和Ⅲ比较可证明 ,将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后 和 都不变.
【结论】氧化铜还能作氯酸钾分解的催化剂,请写出实验Ⅲ中的化学反应文字表达式
【实验反思】实验Ⅱ和Ⅲ对比是为了证明
【提出问题】②双氧水分解速度还和什么因素有关
【设计并完成实验】
| |
双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生产生O2体积 |
| Ⅰ |
50.0g |
1% |
0.1g |
9mL |
| Ⅱ |
50.0g |
2% |
0.1g |
16mL |
| Ⅲ |
50.0g |
4% |
0.1g |
31mL |
本实验中,测量O2体积的装置是 (填编号)
【结论】在相同条件下,双氧水的浓度越大,双氧水分解得越 。
(7分)实验课上,小舟同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
(1)小帆同学却说:“这种无色溶液中不一定含有氢氧化钠”他做了如下实验
| 实验步骤 |
实验现象 |
实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 |
无色酚酞试液变红 |
无色溶液中含有氢氧化钠 |
小玉认为小帆的实验方案也不严密,不能证实无色溶液中一定含有氢氧化钠,理由是:
。
(2)小玉设计了另一个实验:
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量样品于试管中,加入 ②过滤,向滤液中滴加几滴硫酸铜溶液 |
③ ④ |
无色溶液中确实含有氢氧化钠 |
小玉的实验可靠性高的原因是①。
②。
请根据下图回答问题: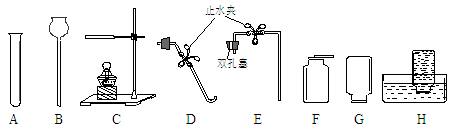
(1)仪器A的名称是,仪器B的名称是。
(2)用KClO3与MnO2混合制取并收集纯净O2,应选用上图中的(填序号),反应的化学方程式。
(3)实验室制取并收集CO2,应选用上图中的(填序号),反应的化学方程式
;如何检验已集满一瓶CO2气体
。
冬天,小方陪妈妈去医院打点滴,发现护士往输液管上放了一个纸包(如图所示),经询问得知它可以温暖输入人体中的液体。小方对包里的东西能产生热量感到很神奇,于是,他向护士要了一只用过的纸包,带回来进行了如下探究。
探究一:包里是什么物质。
他剪开纸包,发现里面是一些黑色粉末和暗红色粉末。
【提出猜想】纸包里的物质可能是炭粉、铁粉、氧化铁、氧化亚铁中某几种物质的混合物。
【查阅资料】氧化亚铁是一种黑色粉末,不溶于水。在空气中稍受热即被迅速氧化成四氧化三铁,铁的氧化物中只有四氧化三铁能被磁铁吸引。四氧化三铁与盐酸反应生成氯化亚铁、氯化铁和水。
【初步结论】根据资料知识,你认为纸包中的黑色粉末除了猜想物质以外,还可能含有。
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
将磁铁靠近粉末 |
黑色粉末部分被吸引,暗红色粉末不被吸引 |
| ② |
取少量粉末加入足量稀盐酸 |
有气泡产生,底部有黑色不溶物 |
【得出结论】⑴该粉末中一定含有。
⑵实验②中产生气泡的化学方程式是__________________________________________。
探究二:纸包为什么会放热。
【查阅资料】铁粉在空气中会发生缓慢氧化而放出热量,转化成氧化铁。
请你写出该反应的化学方程式。
你若能正确完成下面的相关内容将奖励4分。但化学试卷总分不超过60分。
在上面的实验中还不能得出纸包中一定含有四氧化三铁。请你继续完成以下实验内容:
| 实验步骤 |
实验现象 |
结论 |
| 纸包中含有四氧化三铁。 |
我校实验室有一瓶保管不当的试剂,其残缺的标签中只剩下“钠”和“10%”字样(如图所示)。已知它是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究: 
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是下列三类物质中的 (填序号)。
A、酸 B、碱 C、盐
【查阅资料】 Ⅰ、初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ、测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 溶解度/g |
36 |
109 |
21.5 |
9.6 |
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 。
【做出猜想】①可能是NaOH溶液;②可能是溶液;③可能是NaCl溶液。
【设计并实验】 (1)小强取样品少量,滴加无色酚酞试液,液体变红色他认为猜想①正确,他的判断是否合理,原因是。
(2)小华为了检验该溶液到底是什么又进行了如下实验:取样品于试管中,滴加氯化钡溶液,有白色沉淀生成,他得出猜想②正确。相应的化学方程式。
下图是实验探究氢气与氧气混合点燃发生爆炸的条件: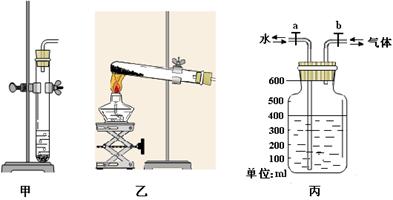
⑴乙装置中对试管加热的仪器名称是;在实验室中利用氯酸钾和二氧化锰制取氧气,反应的化学方程式是;利用锌粒和稀硫酸制取氢气,可以利用下列
(选填“甲”或“乙”)作为发生装置。
⑵利用丙装置可将氢气、氧气收集并混合起来。某次实验的操作过程如下:先将瓶子装满水,打开a、b,从右边导管通入氢气至水面降至400mL,水从左边导管流出(如图),然后继续从右边导管通入氧气至液面降到100mL,关闭b。此时瓶中收集到的混合气体中氢气与氧气的体积比为。打开b,再从左边导管向瓶中加水,使混合气体全部排出,并用一次性保鲜袋收集,直接点燃保鲜袋内的混合气体。实验共四次,实验数据及现象记录如下表,请将表中漏填的数据及现象补填上。
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 氢气与氧气的体积比 |
1︰4 |
2︰3 |
2︰1 |
4︰1 |
| 氢气的体积百分数 |
20% |
40% |
% |
80% |
| 点燃后现象 |
爆炸 |
爆炸 |
保鲜袋燃烧,没有爆炸 |
由此可见氢气与氧气混合发生爆炸,除要达到燃烧的三个条件外,还和氢气的体积分数有关。