相同温度、相同浓度下的六种电解质溶液,其pH由小到大的顺序如图所示,图中:①②③代表的物质可能分别为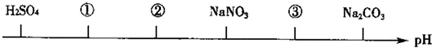
| A.NH4Cl;(NH4)2SO4;CH3COONa | B.(NH4)2SO4;NH4Cl;CH3COONa |
| C.(NH4)2SO4;NH4Cl;NaOH | D.CH3COOH;NH4Cl;(NH4)2SO4 |
已知:2Zn(s)+O2(g)=2ZnO(s)△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s)△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为()
| A.-259.7 kJ·mol-1 | B.-519.4kJ·mol-1 |
| C.+259.7 kJ·mol-1 | D.+519.4kJ·mol-1 |
实验室用4molSO2与2molO2在一定条件下进行下列反应:2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol,当放出315.2kJ热量时,SO2的转化率为()
2SO3(g);△H=-197kJ/mol,当放出315.2kJ热量时,SO2的转化率为()
| A.40% | B.50% | C.80% | D.90% |
500℃条件下,在恒容密闭容器中,充入1molNO2后达到如下平衡2NO2(g) N2O4(g),平衡后,向容器内再充入1mol N2O4(g),下列说法正确的()
N2O4(g),平衡后,向容器内再充入1mol N2O4(g),下列说法正确的()
| A.容器内气体颜色先变浅后变深,最后比原来还要浅 |
| B.反应向逆反应方向移动,所以NO2的百分含量增大 |
| C.容器中的气体密度始终不变 |
| D.N2O4的体积分数增大 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是()
A.CO2(g) + 2NH3(g) CO(NH2)2(s) + H2O(g);△H<0 CO(NH2)2(s) + H2O(g);△H<0 |
B.CO2(g) + H2(g) CO(g) + H2O(g);△H>0 CO(g) + H2O(g);△H>0 |
C.CH3CH2OH (g) CH2=CH2(g) + H2O(g);△H>0 CH2=CH2(g) + H2O(g);△H>0 |
D.2C6H5CH2CH3(g) + O2(g) 2 C6H5CH=CH2(g) + 2H2O(g);△H<0 2 C6H5CH=CH2(g) + 2H2O(g);△H<0 |
已知700K时,N2+3H2 2NH3ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是()
2NH3ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是()
| A.Q = Q1 = 1/2Q2 | B.Q>Q1>2Q2 |
| C.Q>2Q2>Q1 | D.Q = Q1 = Q2 |