(11分)高炉炼铁过程中发生的主要反应为:
| 温度/℃ |
1 000 |
1 150 |
1 300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
 Fe(s)+CO2(g).该反应在不同
Fe(s)+CO2(g).该反应在不同
温度下的平衡常数如下:请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A减少Fe的量 B增加Fe2O3的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
在浓硝酸中放入铜片:
(1)实验现象为。
(2)待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是(用离子方程式表示)
(3)若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6L(标况)。则所消耗硝酸的物质的量是mol。
(I)含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4这4种常见的含硫化合物。回答下列问题:
(1)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。写出该反应的化学方程式:___________________。
(2)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4 = Na2SO4+ K2SO4+ I2+ H2O。
①配平上面的氧化还原反应方程式。
②其中氧化剂是________,若反应中有5 mol电子转移,则生成的碘单质是________mol。
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成。此沉淀是______。
A.BaSO4B.FeSC.BaSO3D.S
(4)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面________________,则发生了钝化。
(II)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4,1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子.试回答:
(1)A是元素,C是元素.
(2)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:、。
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。NO2和CO反应生成CO2和NO反应是放热反应,NO2和CO的总能量(填“>”、“<”或“=”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速率为。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
| A.容器内气体的质量保持不变 |
| B.NO2的物质的量浓度不再改变 |
| C.容器内气体的平均相对分子质量不变 |
| D.NO2的消耗速率与CO2的消耗速率相等 |
E.容器内气体的物质的量保持不变
有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1)B在周期表中的位置______________。
(2)CB2通入A2B2溶液中可被氧化为W,方程式为____________。用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)
电池总反应可表示为:PbO2 +Pb+ 2W= 2PbSO4 + 2H2O 。若电池中转移0.1 mol电子时,则W的浓度由质量分数39 % (密度1.3 g·cm-3)变为____________mol·L-1。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为_________________________。
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是。
A﹣Z都是初中化学的常见物质,其中A是发酵粉的一种主要原料,俗称小苏打,B是胃酸的主要成分,C和M的组成元素相同,常温下E是液体,Y、Z是黑色固体,N是红色粉末,G是一种碱,农业上常用作改良酸性土壤.它们之间有如图反应关系: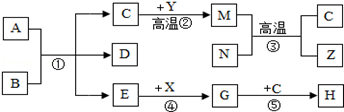
请根据以上信息回答下列问题:
(1)D的化学式为 ;
(2)反应②是 反应(填“吸热”或“放热”);
(3)反应③的化学方程式为 ,该反应中有还原性的 ;
(4)反应⑤的化学方程式为 。