下列有关实验的叙述,正确的是 (填序号,多选一个倒扣1分)
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上端口倒出 |
| B.氢气还原氧化铜实验中,先加热氧化铜后通氢气 |
| C.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片 |
| D.实验室做钠的实验时,余下的钠屑投入到原试剂瓶中 |
E.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
F.不慎将苯酚沾到皮肤上,立即用酒精清洗;
G.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入浓硝酸中,并不断搅拌;
H.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
请回答:
⑴ 滴定时,将KMnO4标准液装在右图中的(填“甲”或“乙”)滴定管中。
⑵ 本实验滴定达到终点的标志可以是。
⑶ 通过上述数据,计算出x=。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会。
下图为蒸馏实验装置: 
⑴ 写出下列仪器的名称:
①;②。
⑵ 在仪器①中还需加入碎瓷片,其作用是:。
⑶ 仪器②使用时水流的方向是:进出(用“f”、“g”填空)。
⑷ 若利用装置I分离四氯化碳和酒精的混合物,还缺少的一种仪器是,错误的一个地方是,
实验中承接液体的容器用锥形瓶而不用烧杯的原因是:
。
下图是实验室制取气体的两种常见发生装置: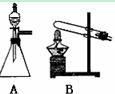
(1)实验室用石灰石跟稀盐酸反应制取二氧化碳,应选用的发生装
置是(请选“A"或“B")。
反应的离子方程式为
(2)用氯酸钾和二氧化锰来制取氧气,应选用的发生装置是________(请选“A"或“B")。
化学反应方程式为
(3)若用A装置制取氧气,所选试剂为,
反应的化学方程式为
(4)用(2)(3)两种方法制取氧气时,若产生相同质量的氧气,则(2)(3)两反应转移的电子数之比为。
为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。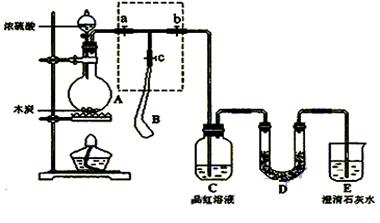
请回答下列问题:
(1)装置A中发生反应的化学方程式为。
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为;
(4)当D中产生现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
(1)下列有关实验的说法、操作或结论不正确的是(填序号)
| A.制备Fe(OH)3胶体时,应往沸水中滴加饱和FeCl3溶液,并继续加热到溶液呈红褐色为止。 |
| B.测定中和热实验中,每次实验均应测量三个温度,即盐酸起始温度,NaOH溶液的起始温度和反应后溶液的最高温度。 |
| C.在一定物质的量溶液配制的过程中,没有洗涤烧杯和玻璃棒、定容时加水超过了刻度线、容量瓶没有干燥均会使所配溶液浓度偏低。 |
| D.往FeCl3溶液中滴入KI—淀粉溶液,溶液变蓝色。 |
E.铝粉和氧化镁或氧化铁粉末混合,高温均能发生铝热反应。
F.验证AgNO3溶液中是否混有Al(NO3)3,可加入过量氨水,如有白色沉淀,则混有Al(NO3)3
G.稀释浓硫酸时,要将水沿容器壁缓慢注入浓硫酸中,并用玻璃棒不断搅拌。
(2)实验室配制500ml 0.1mol/L的Na2CO3溶液,需用托盘天平称取碳酸钠粉末g。
配制时应选用的仪器有,托盘天平、药匙、烧杯、量筒、。