(13分)雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Fe3+、SO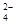 、NO
、NO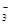 、CO
、CO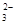 、Cl
、Cl 。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验:
。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验: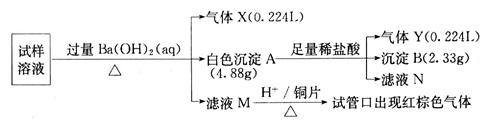
回答下列问题:
(1)气体X是_________,检验该气体通常使用的试剂是_______________________;
(2)沉淀B是_________,在沉淀A中加入足量稀盐酸后,溶解的沉淀是____________;
(3)试样中肯定不存在的离子是___________,不能确定是否存在的离子是_________;
(4)滤液M在酸性条件下与铜片的反应中,还原产物是_________________________。
(5)将实验中得到的气体Y全部通入10mL1.2mol·L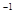 的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
某硫酸厂用以下几种方法处理SO2尾气。
(1)活性炭还原法
反应原理:恒温恒容.2C (s)+2SO2(g) S2(g)+2CO2(g) 。
S2(g)+2CO2(g) 。
反应进行到不同时间测得各物质的浓度如图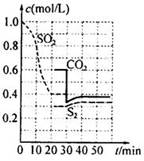
①第一次出现平衡的时间是第min;
②0~20min反应速率表示为V(SO2)=;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是;40min时,平衡常数值为____。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
a.c(Na+)+c(H+) >c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-)+ c(HSO3-)+ C(H2SO3)
c.c(Na+)> c(SO32-)> c(OH一)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
如图所示,Pt(1)电极的反应式为;碱性条件下,用P(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体mol。
(11分)元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素。Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子。请回答下列问题:
(1)Z在周期表中的位置;W基态原于的价电子排布图。
(2)X、Y、Z、Q中,基态原子第一电离能最大的是(填元素符号)。
(3)在XQ—中Q的杂化类型为X的氧化物(X2O)晶体结构示意图如下,则1molX2O晶体含有mol氢键。
(4)ZY3有较强的还原性,遇到NaClO溶液时有无污染的气体生成,其化学方程式为
纳米级Cu2O具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。已知Cu+易在酸性条件下发生:2Cu+=Cu2++Cu。
方法一:在新制Cu(OH)2浊液中滴入N2H4·H2O水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。
(1)写出上述制备过程中的总反应方程式。
(2)用甲醛稀溶液代替N2H4·H2O水溶液也可以实现上述转化,但需水温较高,且往往会生成极少量颗粒较大的Cu2O,用的方法可分离出颗粒过大的Cu2O。
方法二:以铜作阳极,石墨作阴极电解。已知:①铜作阳极时,铜先被氧化生成Cu+,后Cu+继续氧化生成Cu2+;②在碱性溶液中CuCl浊液易转化为Cu2O。
(3)以NaOH溶液作为电解质溶液时需添加NaCl,其目的是,写出阳极反应方程式。
(4)写出在碱性溶液中CuCl浊液转化为Cu2O的离子方程式。
(5)这样制得的Cu2O中往往含有CuCl,请设计实验证明CuCl的存在。
(14分)( I )在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) 2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H0,熵变△S_____0 ( 填:“< ,> ,= ”)。该反应在(填:高温或低温)条件下能自发进行。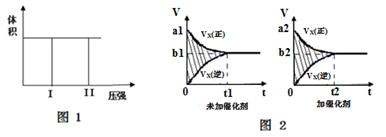
(2)该反应的v-t图像如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图2中右图所示。以下说法正确的是。
①a1>a2②b1<b2③ t1>t2④ 右图中阴影部分面积更大⑤两图中阴影部分面积相等
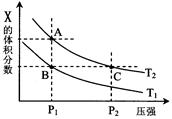
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g) pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡移动(填:向左,向右,不)。
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是mol.。
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。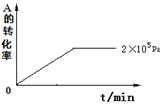
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。常用电离常数Kb和电离度α来定量表示氨水的电离程度,它们均可通过各浓度氨水对应的c(OH-)进行换算。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
| 烧杯号 |
V氨水 (mL) |
V水(mL) |
c (NH3·H2O) (mol·L-1) |
c(OH-) |
Kb |
α |
| 1 |
50.00 |
0.00 |
1.34×10-3 |
|||
| 2 |
25.00 |
25.00 |
9.48×10-4 |
|||
| 3 |
5.00 |
45.00 |
4.24×10-4 |
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb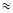 。
。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1
的NaOH溶液和20.00mL0.10mol·L—1氨水所得的滴定曲线如图。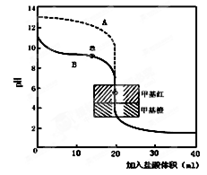
请指出盐酸滴定氨水的曲线为(填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l)△H1①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l)△H2②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)△H3③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1=。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2= 2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为。