如图是实验室干馏煤的装置图,回答下列问题:
(1)反应完毕后,试管A中剩下的灰黑色固体是______________________;
试管B中液体分两层,上层为澄清、透明的水溶液,能使酚酞变红是________,下层的黑色黏稠物是______________________________,
写出其中的成分与HNO3反应的化学方程式(2个)______________________,______________________。
(2)C处点燃的气体在工业上叫________,其主要成分是________。
海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。
实验室里从海藻中提取碘的流程如下图: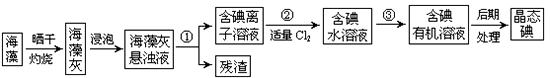
(1)指出提取碘的过程中有关的实验操作名称:①,③;
过程②中有关反应的离子方程式为。
(2)提取碘的过程中,可供选择的有机试剂是
| A.甲苯、酒精 | B. 四氯化碳、苯 四氯化碳、苯 |
C.汽油、乙酸 | D.汽油、甘油 |
(3)从含碘的有机溶液中提取碘和回收有 机溶剂,还须经过蒸馏,指出右面实验装置图中的错误之处:
机溶剂,还须经过蒸馏,指出右面实验装置图中的错误之处:
①;
②;
③。
金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
请回答下列问题:
(1)环戊二烯分子中最多有个原子共平面:
(2)金刚烷的分子式为,其分子中的
:基团有个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应①的产物名称是,反应②的反应试剂和反应条件是,反应③的反应类型是;
(4)已知烯烃能发生如下反应:
请写出下列反应产物的 结构简式:
结构简式:

(5) 是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色, 经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基( , , )或烯基侧链经高锰酸钾酸性溶液氧化得羧基],写出 所有可能的结构简式(不考虑立体异构):
请回答下列实验室中制取气体的有关问题。
( 1)下图是用
与浓盐酸反应制取适量氯气的简易装置。
1)下图是用
与浓盐酸反应制取适量氯气的简易装置。
装置
、
、
的作用分别是:
;
;
.
(2)在实验室欲制取适量
气体。
①下图中最适合完成该实验的简易装置是(填序号);
②根据所选的装置完成下表(不需要的可不填)
|
应加入的物质 |
所起的作用 |
|
|
A |
||
|
B |
||
|
C |
||
|
D |
。
③简单描述应观察到的实验现象。
工业废水中常含有一定量的
和
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:
(1)若平衡体系的
,则溶液显色.
(2)能说明第①步反应达平衡状态的是。
a.
和
的浓度相同
b.
c.溶液的颜色不变
(3)第②步中,还原1mol
离子,需要mol的
。
(4)第③步生成的
在溶液中存在以下沉淀溶解平衡:
常温下, 的溶度积 ,要使 降至 ,溶液的 应调至。
方法2:电解法
该法用
做电极电解含
的酸性废水,随着电解进行,在阴极附近溶液
升高,产生
沉淀。
(5)用
做电极的原因为。
(6)在阴极附近溶液
升高的原因是(用电极反应解释)。
溶液中同时生成的沉淀还有。
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:

 ;
;
的制备原理:
 ↑+
,并设计出原料气的制备装置(如图)
↑+
,并设计出原料气的制备装置(如图)

请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氦气,丙烯。写出化学方程式:,。
(2)若用以上装置制备干燥纯净的
,装置中
和
的作用分别是,;
和
中承装的试剂分别是,。若用以上装置制备
, 气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集
干燥的装置图。
(3)制丙烯时,还产生少量
,
及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是(填序号)
①饱和
溶液②酸性
溶液③石灰水
④无水
⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a. 低温、高压、催化剂 b. 适当的温度、高压、催化剂
c. 常温、常压、催化剂 d. 适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化10-丁醇,该小组查阅文献得知:①
(饱和)→
↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:
粗品 滤液
滤液
 有机层
有机层 1
1 丁醇、乙醚
丁醇、乙醚 纯品
纯品
试剂1为,操作1为,操作2为,操作3为_。