(14分)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2 2NH3的平衡常数K值和温度的关系如下:
2NH3的平衡常数K值和温度的关系如下:
| 温度/℃ |
360 |
440 |
520 |
| K值 |
0.036 |
0.010 |
0.0038 |
(1)①由表中数据可知该反应为放热反应,理由是________________。
②理论上,为了增大平衡时H2的转化率,可采取的措施是______________(填字母序号)。
a增大压强 b使用合适的催化剂 c升高温度 d及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)  CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的 恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是p1________p2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3) 原料气H2还可通过反应CO(g)+H2O(g)  CO2(g)+H2 (g)获取。
CO2(g)+H2 (g)获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为________该温度下反应的平衡常数K值为________。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5 L的容器中进行反应,下列描述能够说明体系处于平衡状态的是____________(填字母序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
硫化氢(H2S)分子中,两个H—S键的夹角接近90°,说明H2S分子的空间构型为;二氧化碳(CO2)分子中,两个C=O键的夹角是180°,说明CO2分子的空间构型为;甲烷(CH4)分子中,两个相邻C—H键的夹角是109°28′,说明CH4分子的空间构型为。
根据下列要求,各用电子式表示一实例:
(1)、只含有极性键并有一对孤对电子的分子
(2)、只含有离子键、极性共价键的物质
(3)、只含有极性共价键、常温下为液态的非极性分子
请指出表中分子的空间构型,判断其中哪些属于极性分子,哪些属于非极性分子,并与同学讨论你的判断方法。
| 分子 |
空间构型 |
分子有无极性 |
分子 |
空间构型 |
分子有无极性 |
| O2 |
HF |
||||
| CO2 |
H2O |
||||
| BF3 |
NH3 |
||||
| CCl4 |
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
⑴写出实验流程中下列物质的化学式
试剂X :沉淀A:沉淀B:
⑵上述实验流程中加入过量的Na2CO3的目的是。
⑶按此实验方案得到的溶液3中肯定含有(填化学式)杂质。
(Ⅰ)A、B、C三种无色可溶性盐分别是由Na+、Ag+ 、Ba2+、Cl—、NO3— 、CO32—中不同的阴、阳离子所组成。经实验A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为、B为。将B和C的溶液混合反应的离子方程式为:。
(Ⅱ)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验: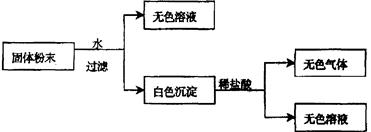
从实验可以判断,该固体粉末中一定不含有,它的组成可能是
或。