(8分) 1 L某混合溶液中可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 |
Cl- Br- I‑ ClO‑ AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示。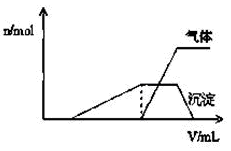
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有 ,
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 。
(2)经检测,该溶液中含有大量的Cl-、Br-、I-若向1 L该混合溶液中通入一定量的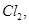 溶液中的Cl-、Br-、I-物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
溶液中的Cl-、Br-、I-物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8 L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5mol |
2mol |
| n(Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
a mol |
0 |
0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为 。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为 。
完成下列小题(共12分)
(1)主链含5个碳原子,有2个甲基作支链的烷烃有_______种。其中有一种同分异构体的分子,其一氯代物有4种同分异构体,写出其结构简式___________________,并对其命名____________。其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称______________.
(2)已知某有机物A在标况下的密度为1.34g/L,取A与氧气反应,得到等物质的量的CO2和H2O,则该有机物的分子式为______________。为测定A的结构,作核磁共振氢谱,发现只有一种吸收峰,则A可能的结构简式为____________。
(14分)为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是__________,电子式是____________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为________,电子式为______________,化学键类型为________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成________,其化学键类型为________;
加热时生成________,其化学键类型为____________________________________。
(10分)现有部分元素的性质与原子(或分子)结构如表所示:
| 元素编号 |
元素性质与原子(或分子)结构 |
| T |
最外层电子数是次外层电子数的3倍 |
| X |
常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y |
M层比K层少1个电子 |
| Z |
第三周期元素的金属离子中半径最小 |
(1)写出元素T的原子结构示意图________。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填字母)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式______。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同),该原子结构示意图为_________。元素⑩名称为在周期表中的位置。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3)用电子式表示元素④与⑥的化合物的形成过程:,该化合物属于(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式,该化合物是由__________________(填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_____________________。
(6)元素③的氢化物的结构式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为______________________。
(9分)I.某烃类化合物A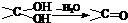 的用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
的用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
(1)现有以下的实验室仪器:
| A.1H核磁共振仪 | B.质谱仪 | C.红外光谱仪 | D.元素分析仪 |
请你选择分别用什么仪器。
①测出相对分子质量(填字母代号,下同),
②测出官能团碳碳双键,
③测出几种类型的氢。
(2)结合题给信息,可以判断A的结构简式为。
II.(1)多羟基连在同一个碳原子上易自动失水生成醛或酮:,根据上述原理,请写出 与NaOH的水溶液共热的化学方程式为:。
与NaOH的水溶液共热的化学方程式为:。
(2)一个碳原子同时接两个碳碳双键不稳定, 与NaOH醇溶液共热可以生成种稳定的二烯烃。
与NaOH醇溶液共热可以生成种稳定的二烯烃。